Закупорка кровеносных сосудов, вызванная сердечно-сосудистыми заболеваниями, может привести к серьезным последствиям, включая сердечный приступ или инсульт. Это состояние можно лечить путем хирургического обхода закупорки с использованием сосуда из другого места тела пациента. Когда это невозможно, обычно используется синтетический сосудистый трансплантат. Однако синтетические трансплантаты имеют высокие показатели отказа из-за хронического воспаления, вызванного отторжением организмом инородного вещества. Другим вариантом являются тканевые сосудистые трансплантаты человека (TEVG), которые демонстрируют многообещающие результаты. в естественных условиях результаты, но требуют длительных, сложных и дорогостоящих процессов для создания.
Теперь исследователи из Лаборатория биоинженерии тканей INSERM (BioTis U1026) в Университете Бордо успешно изготовили TEVG малого диаметра с использованием нитей амниотической мембраны человека (HAM) в сочетании со стратегией ткачества, вдохновленной тканью. Описание процесса в Биофабрикация, они утверждают, что эти трансплантаты обладают замечательными свойствами, которые оправдывают перемещение в в естественных условиях лабораторные испытания на животных.
HAM, самый внутренний слой мембран, окружающих плод во время развития, обеспечивает жизнеспособный биологический «каркас» для тканевой инженерии. Он проявляет противовоспалительные свойства, противомикробное действие, низкую иммуногенность (способность вызывать иммунный ответ), совместимость с кровью, способность удерживать швы и высокую механическую прочность. Он также обычно выбрасывается в больницах и, следовательно, широко доступен и доступен по цене.
Производство пряжи
Главный следователь Николя Л'Эро и его коллеги создали нити HAM из плодных оболочек, взятых у пациенток, давших согласие после кесарева сечения. Они подготовили мембраны для использования, неоднократно промывая ткани в дистиллированной воде, разрезая мембраны на прямоугольные листы размером 10 х 18 см и вручную разделяя амнион и хорион (внутреннюю и внешнюю мембраны). Затем моторизованное режущее устройство нарезало листы ветчины на ленты шириной 5 или 10 мм.
Чтобы создать механически прочные нити, исследователи прикрепляли эти ленты к вращающемуся устройству, которое скручивало их со скоростью 5, 7.5 или 10 оборотов/см. Диаметр пряжи уменьшался после крутки, выходя на плато при 7.5 об/см, в то время как предел прочности при растяжении значительно увеличивался после крутки при 7.5 и 10 об/см.
Нити ветчины (ленты и нити) сушили при комнатной температуре, наматывали и хранили при температуре -80°C. Этот процесс известен как девитализация, поскольку он убивает клетки. При необходимости исследователи регидратировали пряжу в дистиллированной воде.
Поскольку их целью было предоставить готовый имплантат, исследователи изучили влияние децеллюляризации и стерилизации гамма-облучением на ленты HAM. Гистология показала, что децеллюляризация эффективно удаляла клеточные компоненты, оставшиеся после девитализации, не влияла на прочность ТАМ и повышала его растяжимость.
Когда сухие ленты HAM были стерилизованы гамма-излучением, они стали тоньше, жестче и менее растяжимыми. Поддержание гидратации лент HAM во время стерилизации предотвратило многие из этих эффектов. Исследователи заметили, что влажная стерилизация не повлияла на способность HAM поддерживать прикрепление и рост эндотелиальных клеток.
Плетение сосудов
На последнем этапе исследователи собрали нити HAM в TEVG. Они использовали изготовленный на заказ круглоткацкий станок для плетения ТВЭГ вокруг оправки из нержавеющей стали. Для создания тканой трубки между подвижным и неподвижным набором натянутых продольных лент («основа») была вставлена окружная нить («уток»). Два комплекта основы были перемещены, чтобы пересечь уток, круговая нить снова была пропущена между ними, и процесс был повторен 50 раз.
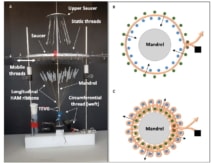
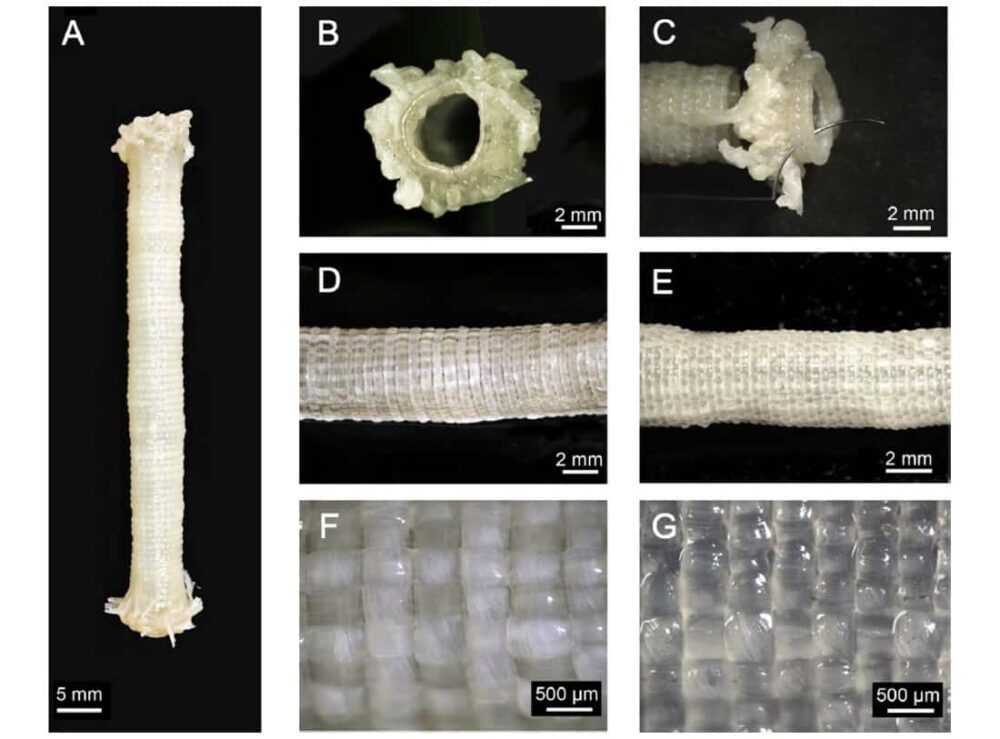
Для плетения ВЭГ со средним внутренним диаметром 51 ± 5 мм коллектив использовал 4.4 продольную ленту (шириной 0.2 мм) и одну двухленточную окружную нить. Тканые TEVG были механически прочными, с превосходной прочностью удержания швов и средним давлением разрыва по сравнению с внутренними грудными артериями человека, предпочтительным сосудом для операции по шунтированию сердца.
Однако, поскольку трансмуральная проницаемость была потенциально слишком высокой, команда изготовила второй набор ТВЭГ с использованием продольных лент шириной 10 мм и такой же конструкции окружной резьбы. Это позволило создать ТЭВГ с большим внутренним диаметром 5.2 ± 0.4 мм. Стенки показали повышенную плотность пряжи и резко сниженную трансмуральную проницаемость. Давление разрыва увеличилось, а сила удержания нити осталась прежней.
«Сочетание недорогого HAM с методом плетения снижает затраты на производство TEVG за счет отказа от использования клеток и биореакторов, которые необходимы в других методах», — пишут авторы. «Ни один метод сборки, используемый сегодня, не позволяет недорого производить ТВЭГ на основе HAM с проверенными механическими свойствами, совместимыми с артериальной имплантацией».

В направлении в пробирке изготовление кровеносных сосудов
Исследователи отмечают, что стратегии сборки, вдохновленные текстилем, с использованием ткачества, вязания и плетения, уже широко используются для производства медицинских устройств. Таким образом, не должно быть сложно спроектировать машины для работы с пряжей из ветчины и обеспечить массовое производство ТВЭГ после проведения успешных клинических исследований. Они добавляют, что диаметр пряжи, механическая прочность и другие механические свойства могут быть легко изменены в соответствии с различными требованиями спецификаций.
Затем исследователи планируют оценить влияние децеллюляризации и гамма-стерилизации после сборки на различные свойства тканого ТВЭГ, особенно в отношении проницаемости и растяжимости.