Termoradioterapija je zdravljenje raka, pri katerem se za izboljšanje učinkovitosti radioterapije uporablja hipertermija – segrevanje tumorja nad telesno temperaturo. Količina tega izboljšanja je izražena kot EQDRT, ekvivalentna doza sevanja, ki je potrebna za dosego enakega terapevtskega učinka brez segrevanja.
Klinična preskušanja so pokazala, da lahko ta pristop bistveno izboljša rezultate zdravljenja pri več vrstah tumorjev, ne da bi povečal toksičnost normalnega tkiva. Prejšnje študije so tudi pokazale, da dosežena temperatura in časovni interval med radioterapijo in hipertermijo vplivata na klinični izid.
Da bi podrobneje razumeli ta proces in pomagali optimizirati zdravljenje, so raziskovalci na Amsterdam UMC uporabili biološko modeliranje za raziskovanje vpliva najvišje temperature in časovnega intervala na EQDRT. Svoje ugotovitve opisujejo v International Journal of Radiation Oncology Biology Physicsporočajo, da so tako visoke temperature kot kratki časovni intervali bistveni za maksimiranje terapevtskega izboljšanja.
Biološki model
Za izvajanje termoradioterapije kliniki uporabljajo radiofrekvenčno ali mikrovalovno napravo, da segrejejo tumor enkrat ali dvakrat na teden, bodisi pred ali po radioterapiji. Temperatura tumorja se ohranja pod 45 °C, da se prepreči segrevanje normalnega tkiva, včasih pa se lahko pojavijo neželene (in boleče) vroče točke, ki omejujejo največjo dopustno raven moči, ki se lahko uporablja med zdravljenjem s hipertermijo.
Prvi avtor Petra Kok in sodelavci razvili programsko opremo za modeliranje bioloških učinkov radioterapije in hipertermije v smislu porazdelitve ekvivalentnih odmerkov. Model, ki upošteva inhibicijo popravljanja DNK s hipertermijo, kot tudi neposredno toplotno povzročeno citotoksičnost, omogoča oceno kakovosti kombiniranih načrtov zdravljenja z uporabo standardnih histogramov odmerek-volumen.
Da bi pridobili osnovni vpogled v vpliv parametrov hipertermije, je skupina najprej izračunala izboljšanje standardne porazdelitve odmerka 23 × 2 Gy s homogenimi temperaturami med 37 in 43 °C za časovne intervale med 0 in 4 ure.
Model je pokazal, da je EQDRT močno povečala tako z naraščajočo temperaturo kot s krajšanjem časovnega intervala. Za časovni interval 1 ure je na primer napovedal EQDRT povečanje za 2–15 Gy pri temperaturah od 39 do 43 °C. Te ugotovitve poudarjajo pomen doseganja najvišje dopustne temperature tumorja za optimizacijo kliničnega izida.
Vpliv časovnega intervala je bil najbolj izrazit pri višjih temperaturah (nad 41°C). Pri tipični hipertermični temperaturi 41.5 °C je EQDRT povečanje za približno 10 Gy je bilo doseženo s časovnim intervalom 0 ur. To se je zmanjšalo na približno 4 Gy povečanje s 4-urnim intervalom, kar kaže, da je s podaljševanjem časovnega intervala potrebna višja temperatura za dosego enakega učinka.
Klinični primeri
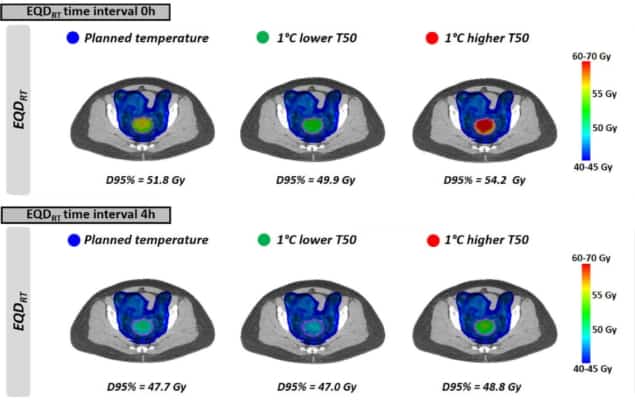
Nato so raziskovalci ocenili realne scenarije zdravljenja na podlagi nehomogenih temperaturnih porazdelitev in kliničnih načrtov radioterapije. Izračunali so EQDRT za 10 bolnic z lokalno napredovalim rakom materničnega vratu. Vsi bolniki so prejeli 23 × 2 Gy volumetrično modulirano obločno terapijo (VMAT), s hipertermijo, ki je bila uporabljena tedensko med zdravljenjem.
Kot je razvidno iz enotnih temperatur, EQDRT je bil največji za najmanjši časovni interval. Ko je bila hipertermija uporabljena tik pred radioterapijo ali po njej (časovni interval 0 ur), je bil povprečni EQDRT do 95 % prostornine (D95 %) je znašal 51.7 Gy – povečanje 6.3 Gy glede na samo sevanje. Povečanje časovnega intervala na 4 ure je to povečanje zmanjšalo na 2.2 Gy.
Model je predvidel, da se večina povečanja odmerka izgubi v prvi uri. Za klinično uporabo mora biti torej čas med radioterapijo in dajanjem hipertermije čim krajši – idealno za bolnike, ki prejemajo obe zdravljenji v isti bolnišnici. Skupina ugotavlja, da čeprav vrstni red obeh zdravljenj ni klinično pomemben, saj je potreben čas za segrevanje tumorja, bi uporaba hipertermije najprej lahko omogočila znatno krajše časovne intervale, celo blizu 0 ur.
Nazadnje so raziskovalci modelirali učinek doseganja nekoliko nižjih temperatur tumorja od načrtovanih zaradi pojava vročih točk, ki omejujejo zdravljenje. Vpliv na EQDRT je bil najbolj izrazit v kratkem časovnem intervalu med radioterapijo in hipertermijo. Za 1 °C nižjo temperaturo in časovni interval 0 ur, na primer, povprečno predvideno EQDRT(D95 %) zmanjšal za 1.8 Gy (z 51.7 na 49.9 Gy); v 4-urnem intervalu je bilo zmanjšanje približno 0.7 Gy.
Radioterapija je učinkovitejša pri segretih tumorjih
V primerih, ko se vroče točke ne pojavijo, je mogoče povečati izhodno moč in doseči višjo temperaturo od načrtovane. Ponovno je bila korist doseganja višje temperature največja za krajše časovne intervale, pri čemer je bil natančen dobiček odvisen od dejanskih doseženih temperatur.
»Biološko modeliranje zagotavlja ustrezen vpogled v razmerje med parametri zdravljenja in pričakovanim EQDRT,« zaključujejo Kok in sodelavci. »Tako visoke temperature kot kratki časovni intervali so bistveni za maksimiranje EQDRT.