Rick Young MIT'de, genomun proteinleri kodlamayan, kodlamayan DNA olarak bilinen kısmından kopyalanan RNA'yı inceleyen bir biyoloji profesörüdür. Genomun bu kısmına bir zamanlar 'çöp DNA' deniyordu, bu da birçok kişinin onun değeri hakkında ne düşündüğüne dair bir fikir veriyor. Bilim adamları, insan genomunun %98'ini oluşturduğunu keşfettiklerinde şaşırdılar ve bu da onun işlevlerini bulma arayışını tetikledi.
Bu sohbette Rick Young şununla sohbet ediyor: Hanne Winarsky Bio Eats World ve a16z genel ortağından Jorge Condebiyoloji, bilgisayar bilimi ve mühendisliğin kesiştiği noktada yatırımlara liderlik eden. a16z'ye katılmadan önce Conde, Syros Pharmaceuticals'da Strateji Direktörü olarak görev yaptı ve genomik yorumlama şirketi Knome'un kurucu ortağıydı.
Konuşma, genomun %98'inin çöp olduğunu düşündüğümüz hakkında öğrendiklerimizi kapsıyor. Eski viral enfeksiyonların kanıtlarını saklamaktan her yüzün benzersiz görünmesini sağlamaya kadar çeşitli görevleri olduğu ortaya çıktı. Aynı zamanda hastalıktaki büyük ama hala tam olarak anlaşılamayan rolünü ve hurda DNA'nın incelenmesinin nasıl kimsenin beklemediği bir gen açma/kapama anahtarının keşfine yol açtığını da tartışıyorlar.
Not: Bu konuşma orijinal olarak bir bölüm olarak yayınlanmıştır. Bio Dünyayı Yiyor. O bölümü dinleyebilirsiniz okuyun.
HANNE WINARSKY: Bugün hurda DNA denilen şey hakkında konuşmak için buradayız. Basit bir tanımla başlayabilir miyiz?
RICK YOUNG: Bu yaklaşık yarım asırlık bir terim. Bilim insanları genomun protein kodlamayan kısımlarını biliyorlardı ve teorize bunun önemsiz olduğunu. Bunların bir kısmının genomun eski viral istilasının kalıntıları olduğunu biliyorduk. Ancak bu ifade, hurda DNA, bizi rahatsız etti.
HANNE: Peki onun yerine kullanmaya çalıştığın terim nedir? Her geçen gün daha iyi anladığımız DNA'nın karanlık maddesi?
RICK: Kodlamayan DNA.
HANNE: Neden bunu döküntü olarak düşündüler? Bazılarının eski virüs parçalarının kalıntısı olduğunu söylemiştiniz. Ama neden başından beri sadece bir gizem değildi?
RICK: Çünkü biyolojik tarih boyunca genetik materyalin ne olduğu konusunda bir tartışma vardı ve başlangıçta bunun protein olduğu düşünülüyordu. Ama proteinin makine, DNA'nın da makinenin planı olduğu anlaşılınca insanlar makinelerle meşgul oldular çünkü makinedeki kusurlar hastalığa neden oluyordu. Ancak daha sonra genomun yalnızca %2'sinin proteinler için amino asitleri kodladığı ortaya çıktı. Büyük çoğunluk, %98, bunu yapmıyor. Ve 2000 yılında, İnsan Genomu Projesi'ndeki bilim insanları sundu İnsan genom dizilimi, bu veriler 98 milyar bazımızın %3.2'inin protein kodlamadığını doğruladı.
Her gen, kodlayacağı proteinin parçalarını ve parçalarını alıp, bir hücrede aldığınız ürünün biraz daha hızlı çalışmasını sağlayacak veya başka bir hücrede gerçekten farklı bir hücreye girebilecek şekilde düzenleme konusunda olağanüstü bir yeteneğe sahiptir. farklı bir iş yapmak için bölme.
JORGE CONDE: Bu 3.2 milyar baz çiftinde kaç genin kodlanacağına dair ilk tahminler nelerdi?
RICK: Yaklaşık 100,000'e karar verdik. Biz ne kadar karmaşık olursak genomun da o kadar büyük olacağını ve gen sayısının da o kadar fazla olacağını varsaydık. Böceklerle bizim hemen hemen aynı sayıda gene sahip olduğumuzu fark ettiğimizde biraz şok yaşadık.
JORGE: İnanılmaz derecede karmaşık bir organizma olduğunu düşündüğümüz şeyi kodlayan gen, beklediğimizden daha azdı, değil mi?
HANNE: Bu biraz şok edici.
Aynı kaynak kodu, farklı programlar
JORGE: Lisede hepimizin öğrendiği şey şuydu; DNA'nın RNA'yı, RNA'nın amino asitleri kodladığı ve amino asitlerin bize proteinleri verdiği, değil mi? Modern biyolojinin temel dogması budur.
RICK: Evet. İnsanların, proteinleri kodlamayan genomun %98'ine "çöp DNA" adını vermelerinin en büyük nedenlerinden biri, büyük ölçüde, genomun ticari amacının proteinleri kodlamak olduğuna inanılmasıydı. proteinler.
JORGE: Peki genetikçiler ne zaman hurda DNA'nın çöpten daha fazlası olabileceğine dair bir fikir edinmeye başladı?
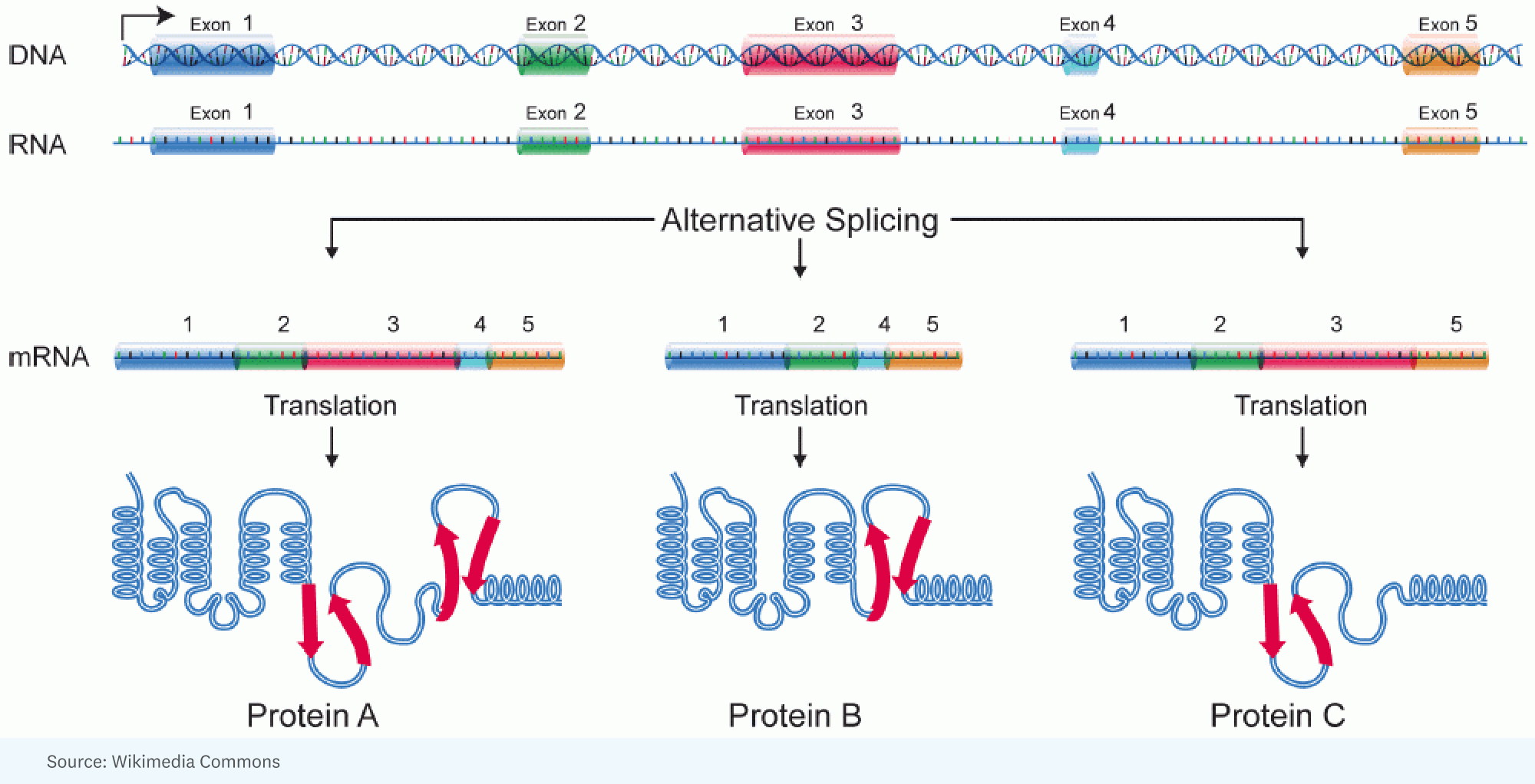
RICK: İnsanlarla böcekler arasındaki ek karmaşıklığın muazzam miktarda alternatif birleştirmeyle açıklanabileceğinin farkına varılmasıyla başladı. Tek bir gen için büyük bir RNA'nın oluştuğu yer burasıdır, ancak bir hücrede diğerine göre farklı şekilde eklenmektedir. Başka bir deyişle, genin farklı kısımları, proteini belirleyecek olan RNA molekülünde son bulur. Yani protein biraz farklıdır.
HANNE: Bu biraz da ışığın farklı vurduğu bir kaleydoskopa benziyor, farklı renkler, farklı açılar elde ediyorsunuz.
RICK: Evet, bu ilginç bir benzetme. Bence bu Lego'lara sahip olduğunuzda daha iyi bir benzetme yapabilirsiniz ve bir makine yapabilirsiniz, ancak bunu pek çok farklı şekilde, pek çok farklı yapıda, renkte yapabilirsiniz. Her gen, kodlayacağı proteinin parçalarını ve parçalarını alıp, bir hücrede aldığınız ürünün biraz daha hızlı çalışmasını sağlayacak veya başka bir hücrede gerçekten farklı bir hücreye girebilecek şekilde düzenleme konusunda olağanüstü bir yeteneğe sahiptir. farklı bir iş yapmak için bölme.
JORGE: Belirli bir insandaki her hücre yaklaşık olarak aynı genoma sahiptir. Ancak aynı genom, inanılmaz çeşitlilikte farklı hücre türlerinin ortaya çıkmasına neden oluyor. Ve bir benzetme yapacağımız ölçüde, her hücre tipi aynı kaynak kodundan farklı bir program çalıştırıyor.
RICK: Doğru.
%98’in işlevleri
JORGE: Farklı hücre türlerine bakıp bunların ne kadar çeşitli olabileceğini görmek için uzman olmanıza gerek yok, değil mi? Bir nöron, örneğin bir kas hücresinden çok çok farklı görünür ve çok çok farklı şekilde çalışır. Bir hücrenin çalıştırmayı seçtiği programı, genetik programı ne belirler? Bir kas hücresini kas hücresi yapan şey nedir ve bir nöronu nöron yapan şey nedir?
RICK: DNA'nın RNA'yı ve [RNA'nın da proteini] ürettiğiyle başladık. Temel dogma budur. Ancak yaklaşık yarım yüzyıl önce bilim insanları, RNA'nın aslında kendi kendine çeşitli işlevler oluşturmaya başladığı iddiasını ortaya atmaya başladılar. Ve RNA'nın aslında gelişimin en erken aşamalarında bir miktar aktiviteye sahip olduğu ortaya çıktı.
Sperm yumurtayla karşılaştığında annenin o yumurtaya koyduğu RNA'dır. Bunu yapan RNA molekülleri var. Rutin olarak kullandığımız antibiyotiklerin RNA'ya bağlandığı ortaya çıktı. Yani RNA'nın burada oldukça önemli rolleri var. Bu insanların düşünme biçimini değiştirdi. Daha sonra hurda DNA'yı düşünmeye başladığımızda, bu, DNA'nın protein kodlamayan kısmıdır. Peki ya dünya proteine değil de RNA'ya dayanıyorsa, en azından başlangıçta başlangıç? Artık hurda DNA dediğimiz ya da eskiden hurda DNA dediğimiz şeyin büyük bir bölümünün çöp olmadığını anlıyoruz. Oldukça işlevseldir. Ve çoğu RNA üretiyor.
Yani herhangi bir hücreyi programlamadaki amacınız, ortak gen gruplarının her birini istediğiniz seviyeye ayarlayacak belirli dizi dizilerini kullanmaktır. . . .Bizim sorunumuz aslında programı bilmememiz.
HANNE: Vay be. DNA'nın kodlamayan kısmını anlamakta bulunduğumuz yer hakkında biraz bilgi verebilir misiniz? Biliyor musunuz, oradaki tüm farklı olasılıklar hakkındaki mevcut anlayışımız nedir?
RICK: Genomumuzun yalnızca %2'si proteinlere giden bu amino asit dizilerini kodluyor. Peki geri kalanların yaptıklarıyla ilgili olarak muhasebecimizin defterinde ne var?
Genomumuzun yaklaşık yarısı heterokromatin dediğimiz şeydir. Antik viral istilaların ürünlerini buradan alırsınız. Antik retrovirüsler istila etti, sonra DNA'ya dönüştürüldü ve genoma yerleştirildi. Yani bu aslında evrimsel tarihimiz boyunca uğraşmak istemediğimiz dizileri gizlemek için kullandığımız bir araçtır. Ve önemli bir istisna dışında genomumuzda sessiz kalıyor.
Diğer yarısı ise tüm aktif protein kodlayan genlerin olduğu ve tüm aktif kodlamayan genlerin bulunduğu yerdir. Peki ne işe yarıyor? Düzenleyici işlevlerin uzun bir listesi var, ancak bunu üçe basitleştireceğim.
İşlevlerinden biri kromozom bakımıdır. Yani bunlar DNA replikasyonunun gerçekleştiği yerlerdir. Bunlar, 2 metre uzunluğunda bir polimer olduğu için genomumuzda onu katlamaktan sorumlu olan bölgelerdir. Birkaç mikron çapındaki çekirdeğe katlanması gerekiyor.
İkinci düzenleyici bölge, gen düzenlemesinden sorumlu olanların tamamıdır. Muhtemelen genomun çok daha fazlası, genlerin kendilerini belirlemekten çok, gen ifadesi için düzenleyici özellikleri belirler. Bunun nedeni, her hücrenin, her gen için farklı bir düzenleyici bölge kullanmasıdır.
HANNE: Çok ilginç, bana sanki bir süreliğine dolaba koymamız gereken şeylerin raflarının olduğu bir dolap ve bir de altyapı dolabı varmış gibi geliyor.
Buna bu kadar odaklanmak neden önemli? Çünkü hastalıkla ilişkili genetik çeşitliliğin %75'inden fazlası burada meydana gelir.
RICK: Evet. Temel olarak sahip olduğunuz şey, her hücrede hem kodlayan hem de kodlamayan ortak bir gen kümesidir. Ve elementleriniz var, yalnızca belirli hücre tiplerinde işleyen gerçek dizileriniz var. Yani herhangi bir hücreyi programlamadaki amacınız, ortak gen gruplarının her birini istediğiniz seviyeye ayarlayacak belirli dizi dizilerini kullanmaktır. Yani 20,000 protein kodlayan genden ve yaklaşık aynı sayıda kodlamayan genden oluşan harika bir müzik enstrümanı çalıyorsunuz. Bunu belirli sıralarla yapıyorsunuz. Bizim sorunumuz aslında programı bilmememiz.
Düzenleyici programın tanıtılması
HANNE: Peki bunu çözmeye nasıl başlayacaksınız? Bu programı anlamaya başladığınızda takip ettiğiniz ipuçları nelerdir?
RICK: Buradaki ipuçları, hücredeki her genin düzenleyici bölgelerinin kendilerini gösterdiği yönünde. Sana söylüyorlar. Ve kullanabilirsiniz çeşitli teknolojiBu size çok hızlı bir şekilde tüm genom boyunca, belirli bir hücre tipinde, diyelim bir motor nöronda, o hücrede bulunan tüm düzenleyici bölgelerin neler olduğunu söyler. Hatta bu genlerin her biri için reostatın nerede ayarlandığını bile görebilirsiniz. Hızlı dizilemenin bize, belirli bir hücre tipinin genomundaki hem kodlayan hem de kodlamayan genler için tüm aktif elemanları eş zamanlı olarak ortaya çıkarma yeteneklerini sağladığı yer burasıdır.
Şu andaki sorunumuz, bunu hemen hemen tek seferde tek bir hücre tipiyle yapmak zorunda olmanız ve elimizde çok, çok yüzlerce hücre tipi var. Bazen belirli bir hücreyi diğer hücrelerle kirlenmeden görmek zordur çünkü tüm dokularımız aslında birden fazla hücre tipinin birleşimidir.
JORGE: Her hücrenin tüm genoma sahip olduğunu, her hücrenin tüm şarkı kitabına sahip olduğunu, belirli hücre türlerinin belirli senfonileri çalmayı seçtiğini ve genomu düzenlemeye yardımcı olan mekanizmanın esasen orkestra şefi olduğunu söylersek, analoji yoluyla tartışmaya değer mi? orkestra? Bu makine, hangi şarkıların çalınacağını, hangi notaların çalınacağını, hangi ses seviyesinde, hangi tempoda vb. çalınacağını belirleyen orkestra şefidir. Bu, genomun düzenleyici işlevini anlamak için makul bir benzetme midir?
RICK: Bu, çıktının ne olacağını görmenin kolay olması anlamındadır. Ama daha da zorlayıcı olan, tüm notları kimin yazdığıdır? Bütün bu notaları oraya koyan ve her şeyi yoluna koyan besteci kim? Bestecinin, hücrelerimizin çoğu ve genlerimizin çoğu için, görevi genlerin düzenleyici unsurlarına bağlanmak ve onlara bir reostat ayarı vermek olan, transkripsiyon faktörleri adı verilen bu protein molekülleri olduğu ortaya çıktı.
Şimdi bunda ilginç bir nokta var çünkü bu transkripsiyon faktörlerinin bağlandığı yerlere biz onlara güçlendirici diyoruz. Bu güçlendirici bölgelerde, aynı zamanda her zaman bağlandıkları bölgeden üretilen bir RNA da vardır. RNA'nın düzenlemede önemli roller oynadığını ancak yakın zamanda anlamaya başladık. Daha da vurgulamak gerekirse: iPhone'unuzun yüzünüzü tanıma şekli, kafatası yüz yapısı genlerini kontrol eden geliştiricilerin her insanda farklılık göstermesinden kaynaklanmaktadır.
Şu anda burada sahip olduğunuz şey bu üçlü hükümdarlıktır. DNA dizisine sahipsiniz. Özel olarak oluşturan molekül olan transkripsiyon faktörü tarafından tanınır, ancak bu üçüncü parçaya, bu RNA molekülüne ihtiyacı vardır. Yani DNA, RNA ve protein aslında bu düzenleyici bölgelerde birlikte çalışır. Peki buna bu kadar odaklanmak neden önemli? Çünkü hastalıkla ilişkili genetik çeşitliliğin %75'inden fazlası burada meydana geliyor.
HANNE: Müzikal açıdan fazla inek olmak istemem ama kulağa neredeyse bir akor gibi geliyor, değil mi? Üç notalı yapının tümü daha büyük bir şey yaratmak için birlikte oynuyor.
RICK: Doğru.
Programcılar
JORGE: Biyolojinin en ileri alanlarından biri, hücre programlarının nasıl belirlendiğine ve hücre kaderinin nasıl belirlendiğine ilişkin bazı yönetim yasalarını anlamaya çalışma yeteneğimizin artmasıdır. Bana göre anlayışımızdaki büyüleyici sıçramalardan biri, Yamanaka'nın yaptığı ve kendisine ödül verilen çalışmadan geldi. Nobel ÖdülüBu, hücreleri çok küçük bir avuç spesifik transkripsiyon faktörüne maruz bırakarak hücre tiplerini yeniden programlayabileceğinizi gösteriyor.
HANNE: Bunun neden bu alanda bu kadar çığır açıcı olduğunu açıklayabilir misiniz?
RICK: O filmde küçük bir rolüm vardı. Bu çok büyük bir sayı olmasına rağmen, az sayıda transkripsiyon faktörünün o hücrenin kimliği için gerekli olan tüm düzenleyici unsurları tanımlayabildiği ortaya çıktı. Ve Yamanaka, bu faktörlerden yalnızca dördünün herhangi bir insan hücresini veya herhangi bir erkek hücreyi embriyonik kök hücreye eşdeğer bir şekilde programlamak için kullanılabileceğini göstererek bunu bize kanıtladı.
Bunu düşünmenin bir yolu, eğer şarkı çok kötüyse organizma yaşamıyor demektir. Ama biraz geç olsa da büyürsünüz, yetişkin olursunuz ve biz yaşlandıkça tüm bu çeşitli hastalıklara yakalanırsınız.
JORGE: Ve bu harika, değil mi? Çünkü bu, sistemin bir şekilde inanılmaz karmaşıklığın basit gibi görünen şeyden çıkarıldığı bir şekilde tasarlandığını gösteriyor. Farklı hücre tiplerini yöneten tüm karmaşık olaylar zincirini belirleyen dört transkripsiyon faktörü.
Yaptığınız çalışmalardan bazıları, bu ana transkripsiyon faktörlerinin esasen bir hücrenin durumunu oluşturması ve sürdürmesi için gerekli olan genleri kontrol eden devrelerin eşdeğerini kurduğunu gösterdi. Gen kontrol devreleri derken neyi kastettiğinizi açıklayabilir misiniz?
RICK: Gen kontrol devrelerinde iki harika unsur var. Birincisi, bir ana düzenleyici bu güçlendiricileri bulduğunda ve hedef genlerin ifadesine neden olduğunda, bu devrenin bir parçasıdır, bu da çıktıdır. Diğer harika unsur ise ana transkripsiyon faktörlerinin aynı zamanda kendi ifadelerini de düzenlemesidir. Yani bir geri bildirim döngüsü var. Mesela, kendi genlerinden kendi ifadelerini kontrol eden ve daha sonra hedef gen grubuna bağlanıp bu genlerin ifadesini kontrol eden ustaların bulunduğu bir elektrik diyagramınız olur.
JORGE: Bu oldukça çılgınca. Transkripsiyon faktörlerinin protein olduğu, proteinin bir gende kodlanan DNA'dan yapıldığı neredeyse döngüsel bir referansa benziyor. Transkripsiyon faktörleri, genlerin transkripsiyonunda ifadeye yardımcı olan mekanizmanın bir parçasıdır. Dolayısıyla transkripsiyon faktörlerinin, yani proteinin, transkripsiyon faktörlerini oluşturan genlerin ekspresyonunu düzenlemeye yardımcı olduğunu söylüyorsunuz.
HANNE: Evet. Tüm bu küçük hücrelerin senfonisinin zihinsel bir görüntüsü var, bilirsiniz, tüm bu farklı dokuları haykırıyor.
Düzenleyici genom ve hastalık
HANNE: Tüm bunların nasıl işlediğini anlamaya başladığımızda ne değişir? Bu bilgiyle ne yapabiliriz?
RICK: Bu ana transkripsiyon faktörlerinin her hücrenin kimliğini yönlendirdiği bu bölgeler, insan varyasyonunun çoğunun hastalığa neden olduğu yerdir. Hastalıkla ilişkili varyasyonun %75'ten fazlası, anahtar genleri yönlendiren bu güçlendirici elementlerde meydana gelir.
JORGE: Tamam. Bu çok çılgınca, değil mi? Hastalığa neden olan veya katkıda bulunan mutasyonları düşündüğümüzde normalde aklımıza, proteini etkileyen, bir şekilde proteini parçalayan ve hastalığa yol açan bir gende meydana gelen mutasyon gelir.
HANNE: Doğru.
JORGE: Ama diyorsunuz ki, vakaların %75'inde bu mutasyon aslında genlerin dışında oluyor, genomun kodlamayan bölgesinde oluyor. Eğer gen şarkıysa, bu şarkının yanlış çalınması değil, çok yüksek sesle, çok yumuşak, çok yavaş veya çok hızlı çalınması değil, pek çok hastalığa neden olan şey budur.
RICK: Aslında bunu düşünmenin bir yolu da şu: Eğer şarkı çok kötüyse organizma yaşamıyor demektir. Ama biraz geç olsa da büyürsünüz, yetişkin olursunuz ve biz yaşlandıkça tüm bu çeşitli hastalıklara yakalanırsınız.
İlk defa aparatları nasıl kurup çalıştıracağınıza dair tüm bu modellere sahibiz.
JORGE: Genin yanlış versiyonunu yapmak değil, genin yanlış dozajını almak. Çok fazla veya çok az.
RICK: Bu doğru. Bununla başa çıkan terapileri nasıl buluyorsunuz? Geni seçici olarak nasıl ayarlarsınız veya azaltırsınız? Prensipte bunu birçok yolla yapabiliriz ve bunu gen terapisiyle de yapabiliriz. Bunu CRISPR gen düzenlemesi ile yapabiliriz. Ancak son birkaç yılda keşfettiğimizi düşündüğüm en önemli şey, bu gen düzenleyici öğelerin her birinin bir RNA'ya sahip olmasıdır. RNA işlevseldir. Bu genin çıktısını ayarlamaya yardımcı olan bir reostadır. Artık yapabileceğiniz birçok yol var ilaç RNA'ları. Elimizde ASO'lar (antisens oligonükleotidler), örneğin spinal müsküler atrofi için Spinraza. Elimizde RNA girişimi var. Ufukta bazı yeni küçük moleküllü ilaçlarımız var. Şimdi bir ilacı, sentetik bir RNA'yı, düzenleyici RNA'yı, düzenleyici RNA'yı düzenlemek için programlamanın yollarını düşünebilseydiniz, herhangi bir hücredeki herhangi bir geni, o hücrenin o ilaca erişebileceği şekilde ayarlamanın temel yoluna sahip olursunuz.
HANNE: Yani bu sadece hastalığın nasıl ortaya çıktığına dair tamamen farklı bir anlayış değil. Ancak bu, hastalıkları potansiyel olarak nasıl tedavi edebileceğimize dair tamamen farklı bir anlayış.
RICK: Kesinlikle. Prensip olarak artık ilgilenilen herhangi bir geni ayarlayan programlanabilir bir ilaç geliştirme yöntemine sahibiz. Şu anda insanlar bu salgına karşı aşı üretmek için sentetik RNA moleküllerini programlıyorlar. Bir aşıdan bekleyeceğiniz kadar iyi bir sonuç.
JORGE: Uygulamaları düşündüğümüzde biyolojide teknoloji, genellikle iki şeyden birini yapmaya çalışıyoruz. Ya biyolojiyi çok derinlemesine sorgulayıp karmaşıklığını artırarak anlamaya çalışıyoruz, ya da müdahale etmeye çalışıyoruz. Biyolojiyi giderek daha derin bir düzeyde sorgulayabiliyoruz, böylece hücrelerin nasıl düzenlendiğine ilişkin yasaları veya kuralları anlıyoruz. Ve buna sahibiz, bunun gibi giderek daha karmaşık hale gelen araçlarımız var programlanabilir tıp yöntemleriRNA'yı çok çok spesifik olarak hedefleyebileceğimiz yer. Bu, bir nevi biyolojiyi sorgulama ve daha sonra giderek daha karmaşık yollarla müdahale etme yeteneğimiz arasındaki verimli döngü olacak. Ve bence bu, bugün kendimizi bu alanda bulduğumuz yerin en heyecan verici yönlerinden biri.
RICK: Sana katılıyorum. Artık karmaşıklığın çoklu katmanlarına dair o kadar derin bir anlayış geliştiriyoruz ki, daha önce görmediğimiz terapötik hipotezler ortaya çıkarabiliyoruz. Bunları sadece birkaç yıl önce hayal bile edemeyeceğimiz bir hızla yapabiliyoruz. Temel bir keşif ile 10 yıl önce insanlara uygulanan terapi arasındaki zamansal mesafe ortalama 14 yıldı. Artık temel bilime dayalı bir tedavi hipotezi ve hastaya dokuz ayda ulaşan bir terapi geliştirmeyi düşünmek mümkün. biz görüyorum bu yeni aşıyla.
HANNE: Yani, sadece ortaya çıkan hastalığı nasıl anladığımızı, onu nasıl tedavi ettiğimizi değil, aynı zamanda bilimin kendisini nasıl yaptığımızı ve bilimin ne kadar hızlı gerçekleşip hastalar için klinik gerçekliğe dönüşebileceğini de değiştiriyoruz.
Bölümlendirici olarak RNA
RICK: Kesinlikle. Ama artık işin üzerine krema var çünkü klasik olarak farmakolojiyi iki şekilde düşündük. Bunlardan biri ilacın birey üzerindeki etkisiydi. Diğeri ise bireyin ilaca etkisiydi. Ve bu son kısımda ilacın dağılımı, hangi dokulara gittiği, hangi dokulara ulaşamadığı konusunda endişeleniyorsunuz. Çünkü ilacın hücreye girdiğinde hücrenin içine yayıldığını ve hedefini bulduğunu varsayıyoruz. Bir asırdır bildiğimiz, zarla çevrili bölmelerimiz var.
JORGE: Hangisi her zaman hücre geçirgenliğiyle ilgili bir soruydu, değil mi? Membranı geçebilir mi?
RICK: Evet. Bir zarı geçebilir mi ve çekirdeğe girebilir mi, giremez mi? Ancak hücrelerde zar dışı birçok organın da bulunduğunu ancak son on yılda anlamaya başladık. biyomoleküler yoğunlaşmalar çünkü bu cisimlerin oluşmasının bir nedeninin, suyun yoğunlaşarak çiy damlasına dönüşmesi gibi yoğunlaşmaları olduğu düşünülüyor. Ancak bu anlayışta bu kadar derin olan şey, bu yoğunlaşmaların proteinleri, DNA'yı ve RNA'yı belirli işlevler için bölümlere ayırmasıdır. Ve şimdi, bir hücredeki 5 ila 10 milyar protein ve RNA molekülünü, arkadaşlarıyla birlikte görev yapacakları çeşitli bölmelere ayırabileceğinizi anladık.
HANNE: Hah.
JORGE: Biyoloji alanından çıkıp fizik alanına mı giriyoruz?
RICK: Tam olarak bunu yaptık çünkü faz ayrımının itici güç olduğu düşünülüyor. Bu matematik tarafından tanımlanan fiziksel bir olgudur.
HANNE: Vay be.
RICK: Şimdi, en etkili kemoterapötik ilaçların şunlar olduğunu öğrendik: yoğunlaşarak hedeflerinin yaşadığı bölmelerin içinde. Hücrenin geri kalanı üzerinde 600 kat yoğunlaşıyorlar, yani onkogenler üzerinde beklediğimizden 600 kat daha fazla hedeflenen aktiviteye sahipler. Bu bize yalnızca gelecek için ilaç keşfi ve geliştirilmesinde önemli olan yepyeni anlayışların olduğunu anlatmakla kalmıyor, aynı zamanda bu yoğunlaşmaların ne yaptığını daha iyi anlama isteğimizi de artırıyor.
İşte pastanın üzerine krema derken kastettiğim şey bu. Hücreyi önemli şekillerde işlevselleştiren bu yoğunlaşma bölmelerinin RNA tarafından düzenlendiğini fark ettik. Oluşumları RNA tarafından uyarılabilir. Çok fazla RNA üretirseniz, reostat'ı 11'e getirirseniz yoğunlaşmayı çözer. Böylece birdenbire, bir hücrenin herhangi bir yerindeki RNA çıktısının, herhangi bir işlevin meydana geldiği yerde yoğunlaşmaları güçlendirerek veya çözerek o işlevi ayarlayabildiğini fark ederiz. Ve bence bu çok önemli çünkü programlanabilir bir RNA'nın, sentetik bir RNA molekülünün, işlevsiz hale gelen bir hücrenin işlevini ayarlamak için kullanılabileceği başka bir yol. İlk defa aparatları nasıl kurup çalıştıracağınıza dair tüm bu modellere sahibiz.
HANNE: Çevirilecek bir düğme daha.
RICK: Peki o zaman onu nasıl kapatacaksın? Öyle uzun RNA yaptığınızda, bunun sadece büyük bir negatif yük dizisi olduğu ve yoğunlaşmayı çözüp geni kapattığı ortaya çıktı. Genler bu şekilde düzenlenir. Yoğunlaşmayı bir RNA ile ayarlarsınız, sonra gen tamamen kopyalandığında oluşan RNA ürünü ile onu kapatırsınız.
HANNE: Süper havalı. Yani gerçekten bir açma ve kapama düğmesi.
RICK: Bu kimsenin beklemediği bir açma/kapama düğmesi. Ve bu, bir kez daha, eğer programlanabilir bir ilacınız varsa, işlevsiz hücresel işlevleri hedeflemenin yeni bir yoluna, terapötik bir soruna yeni bir çözüme sahip olduğunuz anlamına gelir.
JORGE: Bir adamın hurda DNA'sı, başka bir adamın karmaşık genom düzenleyici mekanizmasıdır.
HANNE: Ya da her erkeğin.
15 Temmuz 2022'da yayınlandı
Onu inşa edenlerin söylediği gibi teknoloji, yenilik ve gelecek.
- Andreessen Horowitz
- Biyo ve Bilim
- Bitcoin
- blockchain
- blockchain uyumluluğu
- blockchain konferansı
- coinbase
- zeka
- Fikir birliği
- kripto konferansı
- kripto madenciliği
- cryptocurrency
- Merkezi olmayan
- Defi
- Dijital Varlıklar
- Ethereum
- makine öğrenme
- değiştirilemez jeton
- Platon
- plato yapay zekası
- Plato Veri Zekası
- Platoblok zinciri
- PlatoVeri
- plato oyunu
- Çokgen
- hissesini kanıtı
- W3
- zefirnet