Хірургічна резекція ракової тканини є поширеним методом лікування, який використовується для зменшення ймовірності поширення раку на здорові тканини. Однак ефективність такої операції сильно залежить від здатності хірурга відрізнити ракову тканину від здорової.
Відомо, що метаболічна активність ракової та здорової тканин значно відрізняється: ракові тканини часто мають хаотичний кровотік у поєднанні з низьким рівнем кисню або гіпоксією. Оскільки гіпоксичні ділянки часто зустрічаються в раковій тканині, точна ідентифікація гіпоксії може допомогти відрізнити ракові від здорових тканин під час операції.
Дослідники з Інженерна школа Теєра в Дартмуті і Університет Вісконсін-Медісон досліджують використання флуоресцентних зондів для зображення локальної концентрації кисню в тканинах під час операції в реальному часі. Вони представляють свої висновки в Журнал біомедичної оптики.
Коли флуоресцентні зонди збуджуються світлом, вони повертаються в основний стан і випромінюють світло з іншою енергією. Одразу після освітлення зонди випромінюють короткий оптичний світловий імпульс, відомий як швидка флуоресценція. Деякі зонди також можуть виробляти сигнал відкладеної флуоресценції через деякий час після освітлення.
Незважаючи на те, що і сигнали швидкої, і сповільненої флуоресценції згасають з часом, сигнал швидкої флуоресценції швидко згасає в порівнянні з тривалим згасанням уповільненої флуоресценції. Затримку згасання сигналу флуоресценції можна спостерігати та аналізувати далі, щоб краще зрозуміти метаболічну активність сусідньої тканини.
Оцінка оксигенації в реальному часі
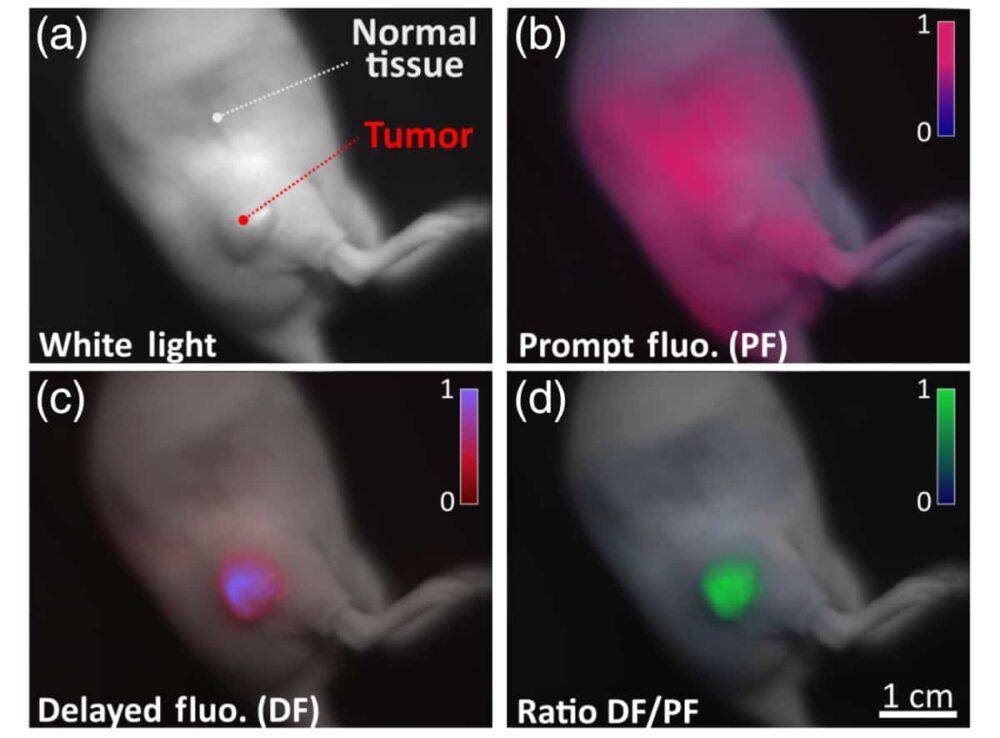
Перший автор Артур Петюссо і його колеги використовували систему оптичної візуалізації для моніторингу світла, випромінюваного ендогенним молекулярним зондом протопорфірином IX (PpIX) у мишачій моделі раку підшлункової залози, де присутні гіпоксичні ділянки.

Дослідники вводили PpIX у вигляді топологічної мазі або шляхом ін’єкції в бік тварини та генерували флуоресценцію, використовуючи 635 нм модульований лазерний діод як джерело збудження. Вони виявили, що відношення затримки до швидкої флуоресценції було обернено пропорційне локальному парціальному тиску кисню в тканині.
Слабка інтенсивність сигналу затримки флуоресценції робить його технічно складним для виявлення. Щоб подолати це, дослідники використовували систему візуалізації з обмеженим часом, яка дозволяє послідовний моніторинг сигналу флуоресценції лише в невеликих часових вікнах. Це дозволило їм зменшити виявлення фонового шуму та точно відстежувати зміни в сигналі затримки флуоресценції.
Подальший аналіз показав, що сигнал сповільненої флуоресценції, отриманий від ракових гіпоксичних клітин, був у п’ять разів більший, ніж сигнал, отриманий від здорової, добре насиченої киснем тканини. Крім того, команда також виявила, що сигнал затримки флуоресценції може бути додатково посилений шляхом пальпації тканини (тиснення на шкіру під час фізичного огляду), що посилює тимчасову гіпоксію та забезпечує часовий контраст між двома сигналами.
«Оскільки в більшості пухлин присутня мікрорегіональна гіпоксія, сигнали гіпоксії від відстроченої флуоресценції PpIX дозволяють отримати чудовий контраст між нормальною тканиною та пухлинами», — говорить Петуссо.
Мультимодальна спектроскопія виявляє пухлини мозку в природних умовах
Дослідники прийшли до висновку, що моніторинг сповільненої флуоресценції, яка виникає через унікальне випромінювання флуоресцентного зонда PpIX за наявності гіпоксії, має кілька переваг у розрізненні здорової та ракової тканин під час операції. «Отримання як швидкої, так і відстроченої флуоресценції у швидкому послідовному циклі дозволило отримати зображення рівнів кисню таким чином, який не залежить від концентрації PpIX», — кажуть вони.
«Потрібна проста технологія та висока частота кадрів у поєднанні з низькою токсичністю PpIX роблять цей механізм контрасту доступним для людей. Його можна легко використовувати в майбутньому як власний механізм контрастування для онкологічного хірургічного лікування», — стверджує Петюссо.