Терапія частинками – лікування раку з використанням пучків протонів або більш важких іонів – забезпечує висококонформну дозу дози та більший захист нормальних тканин, ніж звичайна фотонна радіотерапія. Але для людей, які довго перенесли рак, ризик вторинного раку (СК), спричиненого радіацією, є важливим, і його слід враховувати при виборі методу лікування.
Через брак епідеміологічних даних щодо новітніх методів лікування, таких як протонна та вуглецево-іонна терапія, команда очолила Центр досліджень важких іонів GSI Helmholtz розробляє модель для порівняння ризиків SC між методами терапії частинками. Модель, описана Антонія Хуфнагл та колеги в Медична фізика, зрештою можна включити в системи планування лікування, щоб включити ризик SC як додатковий критерій оптимізації.
Летальні та канцерогенні події
Моделі ризику SC зазвичай працюють, враховуючи баланс між знищенням клітин (що призводить до пригнічення раку) та трансформацією клітин (індукція мутацій, які зрештою призводять до раку). Імовірність того, що опромінений об’єм розвине рак, визначається за допомогою лінійно-квадратичної (LQ) моделі, яка забезпечує простий зв’язок між виживанням клітин і доставленою дозою фотонів.
У цьому дослідженні дослідники використовували модель локального ефекту (LEM) для прогнозування відносної біологічної ефективності (RBE) індукції SC після терапії частинками. Щоб врахувати збільшення RBE випромінювання частинок, вони замінили параметри LQ фотонів у моделі ризику на параметри LQ іонного променя, передбачені LEM. Ключовою особливістю їх підходу є використання LEM як для знищення клітин, так і для індукції раку.

«Подвійне використання LEM відображає конкуренцію між двома основними процесами, що визначають розвиток SC, а саме трансформацією клітин і знищенням клітин», — пояснює старший автор Міхаель Шольц. «Зі збільшенням дози та/або ефективності знищення клітин може пригнічувати життєздатність трансформованих клітин. Це призводить до складної взаємодії, яку неможливо просто відобразити інакше в одноетапній процедурі».
Щоб дослідити, які фактори впливають на ризик СК, дослідники використали систему планування TPS TRiP98 для створення біологічно оптимізованих планів лікування іонами вуглецю та протонами на основі ідеалізованої геометрії. Плани опромінювали мішень розміром 4x4x4 см одним пучком частинок або двома протилежними пучками з органом ризику розміром 4x4x1 см (OAR) перед ціллю. Через невизначеність параметрів LQ фотонів, які використовуються як вхідні дані для LEM, вони оцінили співвідношення ризиків протонів і іонів вуглецю, а не індивідуальні значення ризику.
Для цих ідеалізованих установок модель не показала чіткої переваги ні протонам, ні іонам вуглецю, але виявила складну залежність від різних параметрів. Знижене латеральне розсіювання іонів вуглецю призводить до меншого ризику SC, ніж протони у вхідному каналі. Однак іони вуглецю осідають більш високу дозу позаду мішені через хвіст фрагментації, збільшуючи ризик SC для OAR позаду пухлини після опромінення іонами вуглецю.
Для однопроменевих планів загальний ризик SC був приблизно в 1.5 рази вищий для іонів вуглецю, ніж для протонів. З двома протилежними пучками загальний ризик SC був у 1.16 рази вищим для протонів, хоча це сильно змінювалося залежно від просторового розташування передбачуваного чутливого об’єму щодо цільового об’єму.
Радіочутливість тканини (до фотонів) мала значний вплив на співвідношення ризику СК, причому радіостійкі ОАР отримували користь від обробки іонами вуглецю, а чутливі ОАР – протонні пучки. Навпаки, схема фракціонування мало вплинула на очікувані значення ризику.
Геометрія пацієнта
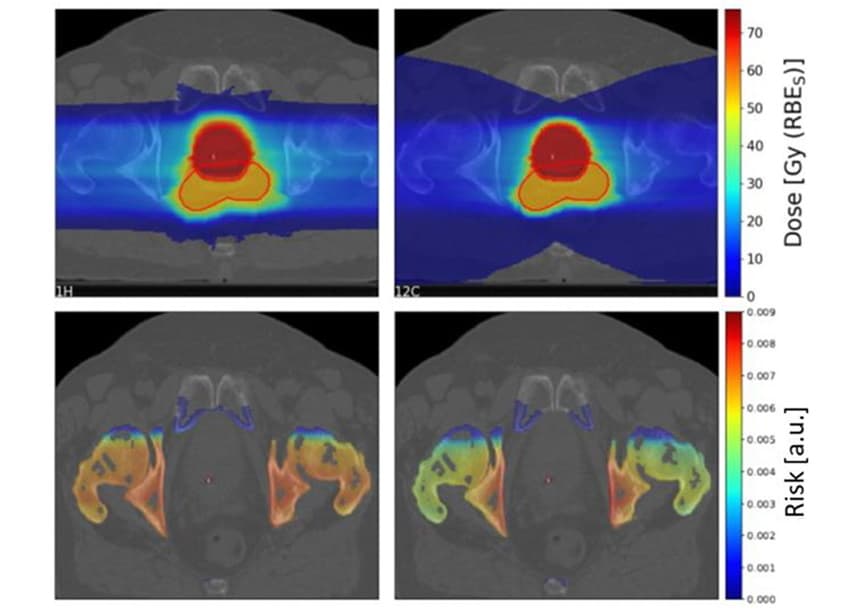
Щоб дослідити клінічні сценарії, Шольц та його колеги оцінили ризики SC для 10 пацієнтів з раком передміхурової залози, які раніше отримували фотонну променеву терапію в лікарні Каролінського університету. Вони створили плани лікування пацієнтів, використовуючи два латерально протилежних відсканованих поля протонів та іонів вуглецю.
Як було показано раніше, хвіст фрагментації іонів вуглецю призвів до великої області низьких доз позаду мішені. Однак цільова область високої дози була більш конформною для вуглецевих іонів, ніж для протонних планів.
Команда розрахувала співвідношення ризику СК від протонів до іонів вуглецю для чотирьох OAR (сечовий міхур, пряма кишка, кістки та шкіра) для 10 пацієнтів. Для кісток і шкіри протонні плани дали дещо вищий ризик SC, ніж плани вуглецевих іонів, із середнім коефіцієнтом ризику 1.19 і 1.06 для кісток і шкіри відповідно. Проте для сечового міхура та прямої кишки протонні плани призвели до значно нижчого ризику SC, із співвідношенням ризиків 0.68 та 0.49 для сечового міхура та прямої кишки відповідно.
Дослідники дійшли висновку, що знання, отримані за допомогою цієї моделі, можуть допомогти оптимізувати майбутні методи лікування. Наразі моделювання відносного ризику в основному підходить як інструмент для порівняння різних сценаріїв лікування для різних когорт пацієнтів. Але Шольц зазначає, що включення таких моделей у планування лікування для окремих пацієнтів було б простим.

Терапія вуглецевою іонною сіткою зберігає здорові тканини
«Потрібно лише запустити планування для заданого розподілу дози з двома різними наборами біологічних параметрів, що представляють процес знищення клітин і процес трансформації клітин відповідно», — пояснює він. «Потім потрібна лише деяка постобробка отриманих розподілів 3D-ефекту за допомогою стандартних математичних інструментів, щоб отримати відповідні розподіли співвідношення ризиків».
Наступним кроком, за його словами, є перевірка моделі шляхом порівняння з клінічними даними. «Оскільки на даний момент цих даних мало, важливим наступним кроком буде розширення підходу для включення фотонної обробки та визначення відповідного співвідношення ризиків протонів проти фотонів і іонів вуглецю проти фотонів», — розповідає Шольц. Світ фізики.