Liệu pháp xạ trị bằng nhiệt là phương pháp điều trị ung thư trong đó tăng thân nhiệt – làm nóng khối u lên trên nhiệt độ cơ thể – được sử dụng để nâng cao hiệu quả của xạ trị. Mức độ tăng cường này được biểu thị bằng EQDRT, liều bức xạ tương đương cần thiết để đạt được hiệu quả điều trị tương tự mà không cần sưởi ấm.
Các thử nghiệm lâm sàng đã chỉ ra rằng phương pháp này có thể cải thiện đáng kể kết quả điều trị ở một số loại khối u mà không làm tăng độc tính của mô thông thường. Các nghiên cứu trước đây cũng chứng minh rằng cả nhiệt độ đạt được và khoảng thời gian giữa xạ trị và tăng thân nhiệt đều ảnh hưởng đến kết quả lâm sàng.
Để hiểu quá trình này chi tiết hơn và giúp tối ưu hóa phương pháp điều trị, các nhà nghiên cứu tại UMC Amsterdam đã sử dụng mô hình sinh học để nghiên cứu tác động của khoảng thời gian và nhiệt độ tối đa lên EQDRT. Mô tả những phát hiện của họ trong Tạp chí quốc tế về ung thư học phóng xạ Vật lý sinh học, họ báo cáo rằng cả nhiệt độ cao và khoảng thời gian ngắn đều cần thiết để tối đa hóa hiệu quả điều trị.
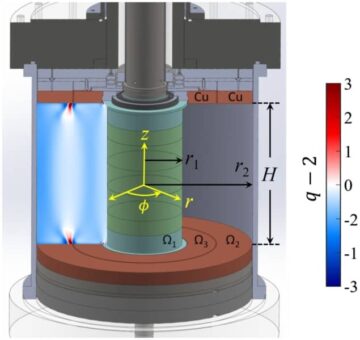
Mô hình sinh học
Để thực hiện liệu pháp xạ trị bằng nhiệt, các bác sĩ lâm sàng sử dụng thiết bị tần số vô tuyến hoặc vi sóng để truyền nhiệt vào khối u một hoặc hai lần một tuần, trước hoặc sau đợt xạ trị. Nhiệt độ khối u được giữ dưới 45°C để tránh làm nóng mô bình thường, nhưng đôi khi có thể xảy ra các điểm nóng không mong muốn (và đau đớn), điều này làm hạn chế mức năng lượng tối đa có thể chịu đựng được có thể được sử dụng trong quá trình điều trị tăng thân nhiệt.
Tác giả đầu tiên Petra Kok và các đồng nghiệp đã phát triển phần mềm để mô hình hóa các tác động sinh học của xạ trị cộng với tăng thân nhiệt về mặt phân bổ liều lượng tương đương. Mô hình này giải thích sự ức chế sửa chữa DNA do tăng thân nhiệt, cũng như độc tính tế bào do nhiệt trực tiếp gây ra, cho phép đánh giá chất lượng của các kế hoạch điều trị kết hợp bằng cách sử dụng biểu đồ thể tích liều lượng tiêu chuẩn.
Để có được hiểu biết cơ bản về tác động của các thông số tăng thân nhiệt, trước tiên, nhóm nghiên cứu đã tính toán mức tăng cường phân bố liều 23 × 2 Gy tiêu chuẩn theo nhiệt độ đồng nhất trong khoảng từ 37 đến 43 °C, trong khoảng thời gian từ 0 đến 4 giờ.
Mô hình cho thấy EQDRT tăng lên đáng kể khi tăng nhiệt độ và giảm khoảng thời gian. Ví dụ: trong khoảng thời gian 1 giờ, nó dự đoán EQDRT tăng 2–15 Gy khi nhiệt độ từ 39 đến 43°C. Những phát hiện này nhấn mạnh tầm quan trọng của việc đạt được nhiệt độ khối u có thể chịu đựng được cao nhất để tối ưu hóa kết quả lâm sàng.
Tác động của khoảng thời gian rõ rệt nhất ở nhiệt độ cao hơn (trên 41°C). Ở nhiệt độ siêu nhiệt điển hình là 41.5°C, EQDRT mức tăng khoảng 10 Gy đã đạt được với khoảng thời gian 0 giờ. Điều này giảm xuống còn khoảng 4 Gy tăng cường với khoảng thời gian 4 giờ, cho thấy rằng khi khoảng thời gian tăng lên, cần có nhiệt độ cao hơn để nhận ra hiệu ứng tương tự.
Ca lâm sàng
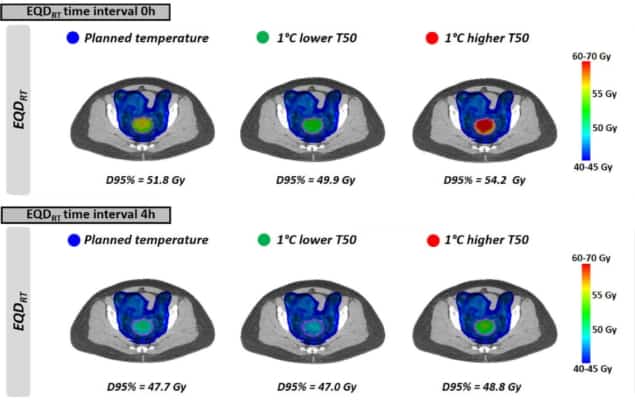
Tiếp theo, các nhà nghiên cứu đánh giá các kịch bản điều trị thực tế dựa trên sự phân bố nhiệt độ không đồng nhất và kế hoạch xạ trị lâm sàng. Họ đã tính toán EQDRT cho 10 bệnh nhân ung thư cổ tử cung tiến triển tại chỗ. Tất cả các bệnh nhân đã được điều trị bằng liệu pháp hồ quang điều biến thể tích 23 × 2 Gy (VMAT), với phương pháp tăng thân nhiệt được áp dụng hàng tuần trong suốt quá trình điều trị.
Như đã thấy với nhiệt độ đồng đều, EQDRT lớn nhất trong khoảng thời gian nhỏ nhất. Khi tăng thân nhiệt ngay trước hoặc sau xạ trị (khoảng thời gian 0 giờ), EQD trung bìnhRT đến 95% thể tích (D95%) là 51.7 Gy – tăng 6.3 Gy chỉ so với bức xạ. Việc tăng khoảng thời gian lên 4 giờ đã giảm mức tăng này xuống còn 2.2 Gy.
Mô hình dự đoán rằng phần lớn sự tăng cường liều lượng sẽ bị mất trong vòng một giờ đầu tiên. Do đó, để sử dụng trong lâm sàng, thời gian giữa xạ trị và điều trị tăng thân nhiệt phải càng ngắn càng tốt - lý tưởng nhất là bệnh nhân được điều trị cả hai phương pháp điều trị trong cùng một bệnh viện. Nhóm nghiên cứu lưu ý rằng mặc dù thứ tự của hai phương pháp điều trị không liên quan đến lâm sàng vì cần có thời gian để làm nóng khối u, nhưng việc áp dụng biện pháp tăng thân nhiệt trước tiên có thể cho phép khoảng thời gian ngắn hơn đáng kể, thậm chí gần đến 0 giờ.
Cuối cùng, các nhà nghiên cứu đã mô hình hóa tác động của việc đạt được nhiệt độ khối u thấp hơn một chút so với kế hoạch do xuất hiện các điểm nóng hạn chế điều trị. Ảnh hưởng đến EQDRT rõ rệt nhất trong khoảng thời gian ngắn giữa xạ trị và tăng thân nhiệt. Ví dụ: đối với nhiệt độ thấp hơn 1°C và khoảng thời gian 0 giờ, EQD dự đoán trung bìnhRT(D95%) giảm 1.8 Gy (từ 51.7 xuống 49.9 Gy); trong khoảng thời gian 4 giờ, mức giảm là khoảng 0.7 Gy.
Xạ trị hiệu quả hơn ở các khối u ấm lên
Trong trường hợp không xuất hiện điểm nóng, có thể tăng công suất đầu ra và đạt nhiệt độ cao hơn kế hoạch. Một lần nữa, lợi ích của việc đạt được nhiệt độ cao hơn là lớn nhất trong khoảng thời gian ngắn hơn, với mức tăng chính xác phụ thuộc vào nhiệt độ thực tế đạt được.
“Mô hình sinh học cung cấp cái nhìn sâu sắc có liên quan về mối quan hệ giữa các thông số điều trị và EQD dự kiến.RT,” Kok và các đồng nghiệp kết luận. “Cả nhiệt độ cao và khoảng thời gian ngắn đều cần thiết để tối đa hóa EQDRT.