介绍
2000 年代初期的人类基因组计划发现,人类只有大约 20,000 个蛋白质编码基因——大约与微小的土壤线虫一样多,不到水稻的一半——令人震惊。不过,人类基因组中存在丰富的调控联系这一想法减轻了对我们自豪感的打击。我们的基因在一个密集的网络中相互作用,在这个网络中,DNA片段和它们编码的分子(RNA和蛋白质)控制着其他基因的“表达”,影响它们是否制造各自的RNA和蛋白质。为了了解人类基因组,我们需要了解基因调控的过程。
然而,事实证明这项任务比解码基因组序列要困难得多。
最初,人们怀疑基因调控只是一个基因产物以数字方式充当另一个基因的开关的简单问题。 1960世纪XNUMX年代,法国生物学家弗朗索瓦·雅各布(François Jacob)和雅克·莫诺(Jacques Monod)首先阐明了 基因调控过程 机械细节:在 大肠杆菌 在细菌中,当阻遏蛋白与 DNA 的特定片段结合时,它会阻止相邻基因组的转录和翻译,这些基因编码消化糖乳糖的酶。这个调节电路被莫诺和雅各布称为 LAC 操纵子,具有简洁、透明的逻辑。
但复杂后生动物(如人类等具有复杂真核细胞的动物)中的基因调控通常似乎并非如此。相反,它涉及一组分子,包括整个染色体的蛋白质、RNA 和 DNA 片段,它们以某种方式协作控制基因的表达。
真核生物中的这种调节过程不仅比细菌和其他简单的原核细胞中常见的参与者更多;而且这似乎是一个完全不同的过程,而且更加模糊。
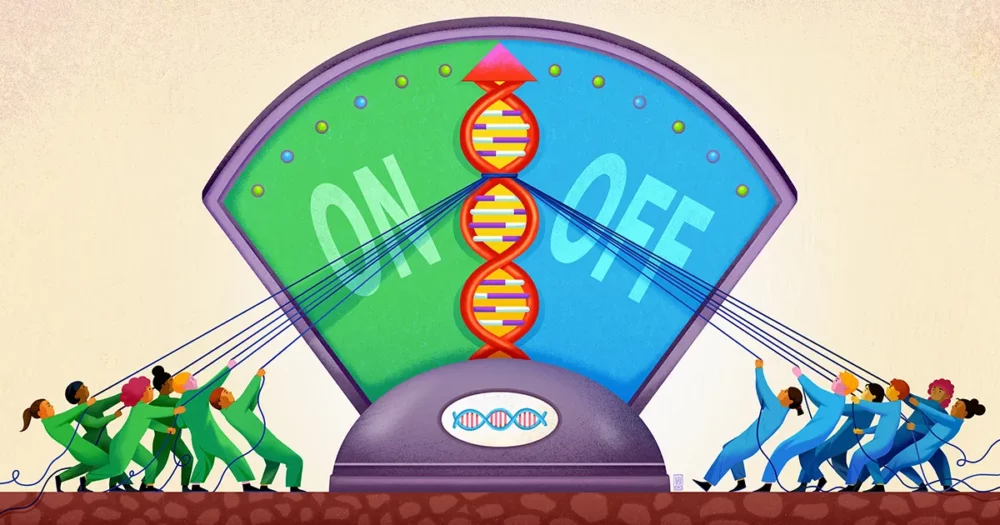
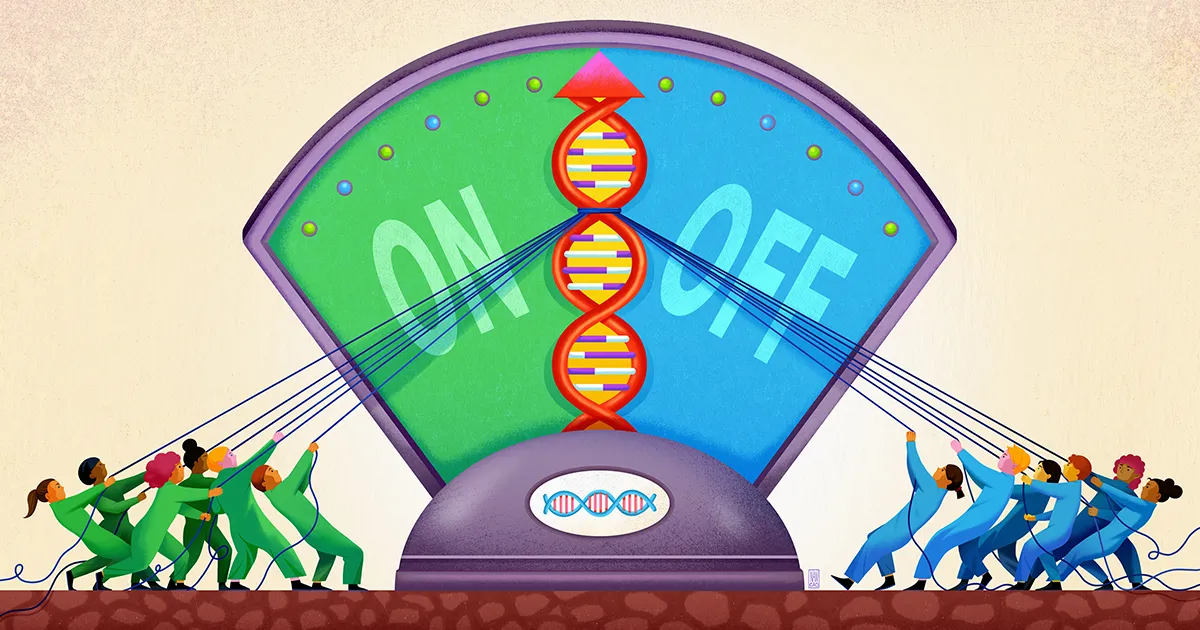
由生物物理学家和生物工程师领导的斯坦福大学团队 波莉·福代斯,现在似乎已经发现了这种模糊基因调控模式的一个组成部分。 他们的工作,去年九月发表于 科学,表明基因附近的 DNA 充当一种浅井的作用,用于捕获不同的调节分子,使它们随时准备采取行动,以便在需要时,它们可以参与决定是否激活该基因。
介绍
这些调节孔是由明显奇怪的 DNA 片段组成的。它们由一段短的 DNA 序列组成,长度从 1 到 6 个碱基对,重复多次。这些“短串联重复序列”(STR)的数十个副本可以在这些序列中串在一起,就像一次又一次写下的同一个小“单词”。
STR 在人类基因组中含量丰富:它们约占我们所有 DNA 的 5%。它们曾经被认为是“垃圾”DNA 的典型例子,因为仅由 STR 组成的重复 DNA“文本”无法容纳与构成句子的不规则字母序列一样多的有意义的信息。文章。
然而,STR 显然并非无关紧要:它们与亨廷顿舞蹈病、脊柱延髓肌萎缩症、克罗恩病和一些癌症等疾病有关。在过去的几十年里,越来越多的证据表明它们可以以某种方式增强或抑制基因调控。令人困惑的是,它们如何在信息内容如此之少的情况下却如此强大。
复杂细胞的复杂控制
为了了解 STR 如何适应基因调控的大局,让我们退后一步。基因的两侧通常都是 DNA 片段,这些 DNA 片段不编码 RNA 或蛋白质,但具有调节功能。细菌基因具有“启动子”区域,聚合酶可以与该区域结合,开始将相邻 DNA 转录为 RNA。它们通常还具有“操纵”区域,阻遏蛋白可以在其中结合以阻止转录,从而关闭基因,就像在 LAC 操纵子。
在人类和其他真核生物中,调控序列可能数量更多、种类繁多,而且令人困惑。例如,称为增强子的区域会影响基因转录的概率。增强子通常是称为转录因子的蛋白质的靶标,这些蛋白质可以结合以增强或抑制基因表达。奇怪的是,一些增强子距离它们所调节的基因有数万个碱基对,只有通过包装染色体中 DNA 环的物理重排才能接近它们。
真核基因调控通常涉及许多不同的 DNA 调控块,以及一个或多个转录因子和其他分子,所有这些都聚集在一个基因周围,就像一个委员会召集起来决定它应该做什么。它们聚集成松散而密集的集群。
通常,分子参与者似乎也不会通过分子生物学中常见的高度选择性的“锁和钥匙”配对进行相互作用。相反,他们不那么挑剔,互动相当弱且没有选择性,就好像四处闲逛并互相进行简短的交谈一样。
事实上,真核生物中转录因子如何与 DNA 结合一直是个谜。长期以来,人们一直认为转录因子的某些部分必须与 DNA 中的结合“基序”序列紧密匹配,就像拼图游戏的各个部分一样。但是,尽管一些这样的基序已经被识别出来,但它们的存在并不总是与科学家在细胞中发现粘附在 DNA 上的转录因子的位置有很好的相关性。有时转录因子会在没有任何基序的区域中徘徊,而一些看起来应该与转录因子紧密结合的基序却是空的。
“传统上,在基因组学中,目标是以[二元]方式通过转录因子将基因组位点分类为‘结合’或‘未结合’”,Fordyce 说。 “但实际情况比这要微妙得多。”这些基因监管“委员会”的个别成员似乎并不总是出席或缺席会议,而是出席或不出席会议的概率不同。
这位生物物理学家说,真核生物中的基因调控往往依赖于大分子复合物之间如此多不同的弱相互作用,“这是众所周知难以从理论上理解的原因之一”。 托马斯·库尔曼 加州大学河滨分校的教授,他写道 评论 在福代斯实验室的论文中 科学。这是一个深刻的谜题,如何从这个看似混乱的过程中产生关于打开和关闭基因的精确决定。
除了决策过程神秘的模糊逻辑之外,还有一个问题是所有委员会成员如何找到正确的房间,然后留在那里。分子通常通过扩散在细胞周围移动,受到所有其他周围分子(例如水)的冲击,并沿随机方向徘徊。我们可能预计这些松散的委员会会很快分裂,无法完成其监管工作。
Fordyce 和她的同事认为,这就是 STR 发挥作用的地方。STR 在 DNA 增强子位点中非常常见。在他们的论文中,研究人员认为 STR 充当粘性补丁,可以召集转录因子并阻止它们迷失。
微调粘性
Fordyce 的研究小组系统地研究了 STR 序列的差异如何影响转录因子与结合基序的粘附。他们研究了两个因素——一个来自酵母,一个来自人类——坚持特定的六碱基基序。当基序两侧是 STR 而不是随机序列时,研究人员测量了这种结合的强度(或亲和力)以及转录因子卡住和松开(动力学)的速率。为了进行比较,他们观察了这些因子与 STR 单独结合以及与完全随机的 DNA 序列结合的容易程度。
“该领域最大的挑战之一是理清影响[转录因子]在基因组特定位置结合的无数变量,”说 大卫·苏特瑞士洛桑联邦理工学院的分子生物学家。 DNA 形状、与其他 DNA 片段的接近程度以及 DNA 分子中的物理张力都可以在转录因子结合中发挥作用。这些参数的值可能在基因组中的每个位置上都不同,并且在细胞类型之间以及在给定位置上随着时间的推移在单个细胞内也可能不同。 “这是一个充满未知变量的巨大空间,很难量化,”苏特说。
介绍
库尔曼补充说,这就是为什么像斯坦福大学团队这样的严格控制的实验如此有用。通常,当研究人员需要测量这样的弱相互作用时,他们有两种选择:他们可以进行一些非常详细、极其精确的测量并从中进行概括,或者他们可以进行大量快速而粗糙的测量并使用数学上复杂的方法统计方法来推断结果。但库尔曼说,福代斯和她的同事使用一种基于微流控芯片的自动化程序在高通量实验中进行精确测量,“以达到两全其美的效果”。
斯坦福大学研究小组发现,不同的 STR 序列可以将转录因子与 DNA 的结合亲和力改变多达 70 倍;它们有时对转录因子结合的影响比改变结合基序本身的序列更大。他们研究的两种不同转录因子的效果也不同。
因此,STR 似乎能够微调转录因子对接 DNA 位点的能力,从而调节基因。但具体如何呢?
基因附近的等候室
研究人员认为,转录因子中结合 DNA 的部分可能与 STR 相互作用较弱,其亲和力的确切强度取决于 STR 序列。因为这种结合很弱,所以不会有太多特异性。但是,如果一个转录因子被 STR 松散地抓住并一次又一次地释放,则累积效应是将转录因子保留在基因附近,以便在需要时更有可能安全地结合到基序区域。
Fordyce 和她的同事预测,STR 可以充当“大厅”或“井”,转录因子可以在调节结合位点附近聚集(无论时间多么短暂)。 “STR 的重复性质放大了由其组成的任何单个结合位点的微弱效应,”说 康纳霍顿该研究的第一作者,现为加州大学伯克利分校的博士生。
相反,他补充说,一些 STR 也可以将转录因子从调控序列中拉出来,像海绵一样吸收其他地方的转录因子。通过这种方式,它们可以抑制基因表达。
Suter 说,这项工作“令人信服地表明 STR 直接影响体外转录因子的结合。”更重要的是,斯坦福大学团队使用机器学习算法表明,在体外实验中看到的效果似乎也发生在活细胞(即体内)中。
但是, 罗伯特·詹伯克利分校的生物化学家、霍华德休斯医学研究所的研究员认为,现在确定给定的 STR 转录因子组合对真实细胞中的基因表达有何影响可能还为时过早。
曾健, 泽维尔·达尔扎克 和他们在伯克利共同管理的实验室的同事一致认为,STR 似乎提供了一种将转录因子集中在基因调控位点附近的方法。然而,如果不知道激活转录所需的因子有多接近,就很难理解该结果的功能意义。 Tjian 表示,他想了解将 STR 引入活细胞中是否会按预期影响目标基因的表达。他说,目前他“不相信 STR 一定会成为体内[调节]机制的一个主要方面。”
组合语法
一个挥之不去的难题是,这种机制如何可靠地提供细胞所需的精确基因调控类型,因为 STR 孔内转录因子结合的强度和选择性都很弱。 Fordyce 认为,这种影响的特异性可能有很多来源——不仅来自 STR 序列的差异,还来自转录因子和其他参与调节的蛋白质之间的合作相互作用。
Horton 说,考虑到所有这些,目前尚不清楚是否可以直接预测给定 STR 转录因子组合对基因表达的影响。这个过程的逻辑确实很模糊。霍顿补充说,影响的“语法”可能是组合性的:结果取决于转录因子和其他分子的不同组合。
斯坦福大学研究小组认为,也许 90% 的转录因子对 STR 敏感,但人类基因组中转录因子的类型比 STR 的类型要多得多。 Horton 说:“STR 序列突变可能会影响该细胞类型中 20 种不同转录因子的结合,导致附近基因的转录整体下降,而不涉及任何特定的转录因子。”
因此,实际上,斯坦福大学团队同意 Tjian 的观点,即活细胞中的基因调控不会由单一、简单的机制驱动。相反,转录因子、它们的 DNA 结合位点和其他调节分子可能会聚集成密集的聚集体,共同发挥它们的影响力。
“现在有多个例子支持这样的观点,即 DNA 元件可以将转录因子聚集到与辅因子形成缩合物的程度,”说 理查德·杨麻省理工学院怀特海德研究所的细胞生物学家。增强子结合许多转录因子以产生这种拥挤。 STR 可能是帮助聚集转录因子聚集在基因附近的成分,但它们并不是全部。
为什么要以这种复杂的方式调节基因,而不是依赖于原核生物中占主导地位的调节蛋白和 DNA 位点之间的强烈而特异性的相互作用?有可能正是这种模糊性使得大型复杂的后生动物成为可能。
为了成为可行的物种,生物体需要能够进化并适应不断变化的环境。如果我们的细胞依赖于某种巨大但严格规定的基因调控相互作用网络,那么在不破坏整个装置的情况下很难对其进行任何改变,就像如果我们移除(甚至稍微取代)任何一个瑞士手表,瑞士手表就会失灵。无数的齿轮。然而,如果监管分子相互作用松散且相当不具体,系统中就会存在有用的松弛——就像即使其中一名成员生病,委员会通常也能做出好的决定一样。
福代斯指出,在细菌等原核生物中,转录因子可能相对容易找到它们的结合位点,因为要搜索的基因组较小。但随着基因组变得越来越大,这变得越来越困难。福代斯说,在真核生物的大基因组中,“你不能再忍受暂时卡在‘错误’结合位点的风险,”因为这会损害快速响应不断变化的环境条件的能力。
此外,STR 本身具有高度进化性。它们的序列延长或缩短,或者“转录因子孔”的大小和深度的改变,很容易通过 DNA 复制或修复中的事故或通过染色体的有性重组而发生。对于 Fordyce 来说,这表明 STR“因此可以作为进化新调控元件和微调现有调控模块以实现敏感转录程序的原材料”,例如那些控制动物和植物发育的调控模块。
弱相互作用的力量
这些考虑促使分子生物学家更加关注基因组中较弱且相对无选择性的相互作用。其中许多涉及的蛋白质不是具有固定和精确的结构,而是松散且松软的——正如生物化学家所说的“本质上无序”。杨解释说,如果蛋白质只能通过刚性结构域发挥作用,那么它不仅会限制调节系统的进化程度,还会限制生命中动态调节的种类。 “你不会发现一个活的有机体——甚至是病毒——只像瑞士手表那样仅靠稳定的结构元件发挥作用,”杨说。
也许进化只是偶然发现 STR 作为真核生物基因调控这一复杂但最终更有效的解决方案的组成部分。 STR 本身可能以多种方式产生,例如,通过 DNA 复制中的错误或称为转座元件的 DNA 片段的活动,这些片段在整个基因组中进行自身复制。
“碰巧的是,蛋白质和重复序列之间出现的弱相互作用可以……为发生这种情况的细胞提供选择性优势,”库尔曼说。他的猜测是,这种模糊性可能是真核生物被迫的,但“它们随后能够利用[它]为自己谋取利益。”细菌和其他原核生物可以依赖明确定义的“数字”调节逻辑,因为它们的细胞往往仅以几种简单、独特的状态存在,例如移动和复制。
但后生动物的不同细胞状态“要复杂得多,有时接近连续体”,苏特说,因此更模糊的“模拟”调节可以更好地服务于它们。
“细菌和真核生物的基因调控系统似乎确实存在很大差异,”Tjian 表示同意。据说莫诺曾经说过:“对于 E。大肠杆菌 对于大象来说也是如此。”但似乎情况并非总是如此。
- :具有
- :是
- :不是
- :在哪里
- ][p
- $UP
- 000
- 20
- 70
- a
- 对,能力--
- Able
- 关于
- 缺席
- 丰富
- 积累
- 法案
- 演戏
- 操作
- 激活
- 活动
- 行为
- 适应
- 加
- 添加
- 邻
- 优点
- 影响
- 亲和力
- 再次
- 议定
- 同意
- 算法
- 所有类型
- 单
- 沿
- 还
- 尽管
- 时刻
- 其中
- 放大
- an
- 和
- 动物
- 另一个
- 任何
- 除了
- 保健
- 争论
- 出现
- 围绕
- 刊文
- AS
- 方面
- 假定
- At
- 关注我们
- 作者
- 自动化
- 远离
- 背部
- 菌
- 基地
- BE
- 因为
- 成为
- 很
- 开始
- 作为
- 得益
- 伯克利
- 最佳
- 更好
- 之间
- 大
- 查看大图
- 大
- 最大
- 绑定
- 捆绑
- 生物学
- 阻止
- 吹氣梢
- 吹
- 促进
- 都
- 带
- 但是
- by
- 加州
- 被称为
- 来了
- CAN
- 细胞
- 细胞
- 一定
- 挑战
- 更改
- 改变
- 选择
- 染色体
- 情况
- 经典
- 分类
- 清除
- 明确地
- 关闭
- 密切
- 簇
- 合作
- 同事
- 统
- 组合
- 组合
- 如何
- 委员会
- 相当常见
- 对照
- 复杂
- 复杂
- 元件
- 妥协
- 条件
- 连接
- 注意事项
- 内容
- 连续
- 控制
- 控制
- 对话
- 合作社
- 可以
- 情侣
- 人群
- 几十年
- 决定
- 决定
- 决定
- 解码
- 减少
- 根据
- 依靠
- 深度
- 细节
- 详细
- 研发支持
- 不同
- 差异
- 不同
- 难
- 扩散
- 数字
- 数码时尚
- 直接
- 发现
- 疾病
- 不同
- 不同
- 的DNA
- do
- 码头
- 不会
- 域名
- 主宰
- 别
- 驱动
- 配音
- ,我们将参加
- 动态
- 早
- 容易
- 易
- 效果
- 有效
- 影响
- 或
- 分子
- 象
- 别处
- 出现
- 提高
- 环境的
- 故障
- 甚至
- 所有的
- 证据
- 进化
- 发展
- 演变
- 究竟
- 例子
- 例子
- 存在
- 现有
- 期望
- 实验
- 解释
- 利用
- 表达
- 非常
- 事实
- 因素
- 因素
- 时尚
- 联邦
- 少数
- 部分
- 想通
- 找到最适合您的地方
- 姓氏:
- 适合
- 固定
- 针对
- 强迫
- 申请
- 发现
- 法语
- 止
- 实用
- 运作
- 功能
- 刚
- 收集
- 搜集
- 聚会
- 通常
- 基因组学
- 得到
- 得到
- 特定
- 目标
- 去
- 非常好
- 治理
- 大
- 团队
- 猜
- 半
- 处理
- 发生
- 硬
- 更难
- 有
- 有
- he
- 帮助
- 这里
- 高度
- 他的
- 举行
- 创新中心
- 但是
- HTML
- HTTPS
- 巨大
- 人
- 人类
- 主意
- 确定
- if
- 影响力故事
- in
- 包含
- 的确
- 个人
- 影响
- 影响
- 信息
- 微不足道
- 代替
- 研究所
- 相互作用
- 互动
- 互动
- 成
- 介绍
- 不变地
- 涉及
- 参与
- 涉及
- IT
- 它的
- 本身
- 雅各
- 拼图
- 工作
- 只是
- 保持
- 保持
- 类
- 种
- 会心
- 实验室
- 大
- 名:
- 领导
- 学习
- 导致
- 减
- 生活
- 喜欢
- 容易
- 链接
- 小
- 活的
- 逻辑
- 长
- 不再
- 看着
- 机
- 机器学习
- 制成
- 杂志
- 主要
- 使
- 制作
- 方式
- 许多
- 美国马萨诸塞州
- 麻省理工学院
- 匹配
- 材料
- 数学
- 问题
- 可能..
- 也许
- 有意义的
- 衡量
- 测量
- 机制
- 机制
- 医生
- 会议
- 成员
- 方法
- 可能
- 麻省理工学院简介
- 时尚
- 模块
- 分子
- 分子
- 更多
- 移动
- 移动
- 许多
- 多
- 必须
- 无数的
- 神秘
- 神秘
- 自然
- 近
- 几乎
- 一定
- 需求
- 打印车票
- 网络
- 没有
- 现在
- 细微的
- 众多
- 发生
- 发生
- 发生
- of
- 折扣
- 提供
- 经常
- on
- 一旦
- 一
- 仅由
- or
- 其他名称
- 我们的
- 输出
- 成果
- 超过
- 最划算
- 己
- 包装
- 配对
- 对
- 纸类
- 参数
- 部分
- 与会者
- 特别
- 过去
- 补丁
- 也许
- 说服
- 的
- 图片
- 件
- Plants
- 柏拉图
- 柏拉图数据智能
- 柏拉图数据
- 播放
- 球员
- 点
- 位置
- 可能
- 功率
- 强大
- 精确的
- 预测
- 都曾预测
- 存在
- 当下
- 自豪
- 大概
- 程序
- 过程
- 生产
- 产品
- 深刻的
- 训练课程
- 项目
- 蛋白质
- 蛋白质
- 提供
- 提供
- 证明
- 出版
- 放
- 困扰
- 题
- 很快
- 相当
- 随机
- 率
- 宁
- 原
- 容易
- 准备
- 真实
- 地区
- 地区
- 调节
- 税法法规
- 监管
- 相对
- 发布
- 依靠
- 依托
- 留
- 说
- 去掉
- 修复
- 重复的
- 复制
- 研究人员
- 那些
- 回应
- 导致
- 导致
- 成果
- 米类
- 丰富
- 右
- 硬性
- 风险
- 河滨
- RNA
- 角色
- Room
- 常规
- 运行
- 说
- 同
- 对工资盗窃
- 科学家
- 安全
- 看到
- 似乎
- 似乎
- 似乎
- 看到
- 段
- 中模板
- 抢占
- 可选择的
- 敏感
- 句子
- 九月
- 序列
- 服务
- 已服务
- 几个
- 有性
- 浅
- 形状
- 短
- 应该
- 显示
- 意义
- 简易
- 自
- 单
- 网站
- 网站
- SIX
- 尺寸
- 松弛
- 小
- So
- 方案,
- 一些
- 不知何故
- 东西
- 有时
- 来源
- 太空
- 具体的
- 特异性
- 稳定
- 斯坦福
- 斯坦福大学
- 州
- 统计
- 留
- 步
- 症结
- 黏
- Stop 停止
- 故事
- 简单的
- 实力
- 强烈
- 非常
- 结构
- 结构体
- 学生
- 学习
- 后来
- 基本上
- 这样
- 糖
- 提示
- 套房
- SUPPORT
- 肯定
- 周围
- 瑞士人
- Switch 开关
- 瑞士
- 系统
- 产品
- 采取
- 串联
- 目标
- 目标
- 任务
- 团队
- 专业技术
- 告诉
- 易于
- HAST
- 比
- 这
- 其
- 他们
- 他们自己
- 然后
- 那里。
- 因此
- 博曼
- 他们
- 事
- 认为
- 想
- Free Introduction
- 那些
- 虽然?
- 思想
- 数千
- 通过
- 始终
- 从而
- 紧紧
- 次
- 时
- 至
- 一起
- 也有
- 翻译
- 透明
- 诱捕
- true
- 谈到
- 二
- 类型
- 类型
- 一般
- 乌克尔
- 最终
- 裸露
- 理解
- 大学
- 美国加州大学
- 不明
- 上
- 使用
- 用过的
- 有用
- 平时
- 价值观
- 各个
- 广阔
- 非常
- 可行
- 病毒
- 音色
- 等候
- 是
- 了解
- 水
- 方法..
- 方法
- we
- 弱
- 网页
- 井
- 定义明确
- 井
- 为
- 什么是
- ,尤其是
- 是否
- 这
- 而
- WHO
- 全
- 全
- 为什么
- 将
- 中
- 也完全不需要
- 工作
- 工作
- 世界
- 蠕虫
- 将
- 书面
- 写
- 但
- 完全
- 年轻
- 和风网