热放射疗法是一种癌症治疗方法,其中使用热疗——将肿瘤加热到体温以上——来提高放射疗法的疗效。 这种增强的数量表示为 EQDRT, 在不加热的情况下达到相同治疗效果所需的等效辐射剂量。
临床试验表明,这种方法可以显着改善几种肿瘤类型的治疗效果,而不会增加正常组织的毒性。 以前的研究还表明,达到的温度以及放疗和热疗之间的时间间隔都会影响临床结果。
为了更详细地了解这个过程并帮助优化治疗,研究人员在 阿姆斯特丹联电 已使用生物模型研究最高温度和时间间隔对 EQD 的影响RT. 描述他们的发现 国际放射肿瘤学生物学物理学杂志,他们报告说,高温和短时间间隔对于最大限度地提高治疗效果都是必不可少的。
生物模型
为了进行热放射治疗,临床医生在放射治疗之前或之后每周使用射频或微波设备对肿瘤加热一次或两次。 肿瘤温度保持在 45°C 以下以防止加热正常组织,但有时会出现不需要的(和疼痛的)热点,这限制了热疗期间可使用的最大耐受功率水平。
第一作者 佩特拉角 及其同事开发了软件,根据等效剂量分布对放疗加热疗的生物学效应进行建模。 该模型解释了热疗对 DNA 修复的抑制以及直接热诱导的细胞毒性,能够使用标准剂量体积直方图评估联合治疗计划的质量。
为了获得对热疗参数影响的基本了解,该团队首先计算了 23 至 2 °C 之间的均匀温度对标准 37 × 43 Gy 剂量分布的增强,时间间隔为 0 至 4 小时。
该模型表明,EQDRT 随着温度的升高和时间间隔的缩短显着增加。 例如,对于 1 小时的时间间隔,它预测 EQDRT 温度从 2 到 15°C 增加 39-43 Gy。 这些发现强调了实现最高可耐受肿瘤温度以优化临床结果的重要性。
时间间隔的影响在较高温度(高于 41°C)时最为明显。 在 41.5°C 的典型过热温度下,EQDRT 以 10 小时的时间间隔实现了约 0 Gy 的增加。 这减少到 4 Gy 左右的增强,间隔为 4 小时,表明随着时间间隔的增加,需要更高的温度才能实现相同的效果。
临床病例
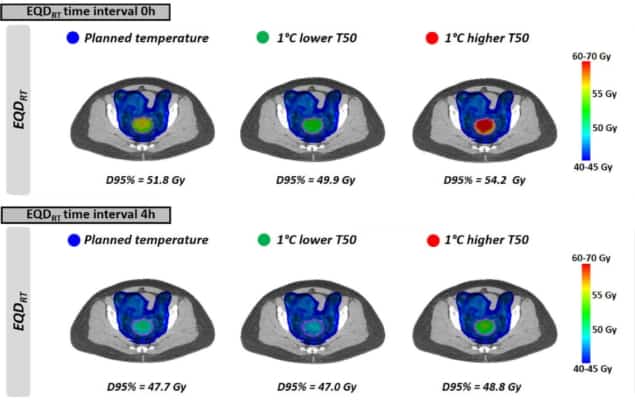
接下来,研究人员根据不均匀的温度分布和临床放射治疗计划评估了现实的治疗方案。 他们计算了 EQDRT 10例局部晚期宫颈癌患者。 所有患者都接受了 23 × 2 Gy 容积调制弧治疗 (VMAT),治疗过程中每周进行热疗。
正如在均匀温度下看到的那样,EQDRT 在最小的时间间隔内是最大的。 当在放疗之前或之后立即应用热疗(0 小时时间间隔)时,平均 EQDRT 到 95% 体积 (D95%) 的剂量为 51.7 Gy——比单独放疗增加了 6.3 Gy。 将时间间隔增加到 4 小时可将此增益减少到 2.2 Gy。
该模型预测大部分剂量增强会在第一个小时内消失。 因此,对于临床使用,放疗和热疗之间的时间应尽可能短——最好是患者在同一家医院接受这两种治疗。 该团队指出,虽然这两种治疗的顺序在临床上并不相关,因为加热肿瘤需要时间,但首先应用热疗可以显着缩短时间间隔,甚至接近 0 小时。
最后,由于出现限制治疗的热点,研究人员模拟了实现比计划略低的肿瘤温度的影响。 对 EQD 的影响RT 放疗和热疗之间的短时间间隔最为明显。 例如,对于 1°C 的较低温度和 0 小时的时间间隔,平均预测 EQDRT(D95%) 减少了 1.8 Gy(从 51.7 Gy 到 49.9 Gy); 对于 4 小时的间隔,减少量约为 0.7 Gy。
放疗对预热肿瘤更有效
在没有出现热点的情况下,可能会增加输出功率并达到比计划更高的温度。 再一次,达到更高温度的好处对于更短的时间间隔是最大的,确切的增益取决于实际达到的温度。
“生物建模提供了对治疗参数与预期 EQD 之间关系的相关见解RT”Kok 及其同事总结道。 “高温和短时间间隔对于最大化 EQD 至关重要RT.