活细胞荧光显微镜为研究生物系统动力学提供了不可或缺的工具。但许多生物过程——例如细菌细胞分裂和线粒体分裂——都是零星发生的,这使得捕捉它们具有挑战性。
持续以高帧速率对样本进行成像将确保当这种划分确实发生时,它们肯定会被记录下来。但过度的荧光成像会导致光漂白,并可能过早地破坏活样品。与此同时,较慢的帧速率可能会丢失感兴趣的事件。我们需要的是一种方法来预测事件何时即将发生,然后指示显微镜开始高速成像。
瑞士洛桑联邦理工学院的研究人员(EPFL)已经创建了这样一个系统。该团队开发了一个事件驱动采集 (EDA) 框架,可自动控制显微镜以详细成像生物事件,同时限制样品的压力。 EDA 使用神经网络检测感兴趣事件的微妙前兆,并根据响应调整采集参数(例如成像速度或测量持续时间)。

“智能显微镜有点像自动驾驶汽车。它需要处理某些类型的信息和微妙的模式,然后通过改变其行为来做出反应,”首席研究员解释道 苏莉安娜·曼利 在一份新闻声明中。 “通过使用神经网络,我们可以检测到更微妙的事件,并利用它们来驱动采集速度的变化。”
EDA 框架,描述于 自然方法,由实时图像流和显微镜控制之间的反馈回路组成。研究人员使用 Micro-Manager 软件从显微镜捕获图像,并使用经过标记数据训练的神经网络来分析它们。对于每个图像,网络输出充当决策参数,在慢速和快速成像之间切换。
事件识别
为了展示他们的新技术,Manley 和同事将 EDA 集成到即时结构照明显微镜中,并用它来捕捉线粒体和细菌分裂的超分辨率延时电影。
线粒体分裂是不可预测的,通常每隔几分钟发生一次,持续数十秒。为了预测分裂的开始,研究小组训练神经网络来检测收缩,即导致分裂的线粒体形状的变化,以及自发分裂所需的一种名为 DRP1 的蛋白质的存在。
神经网络输出“事件分数”的热图,其中较高的值(当收缩和 DRP1 水平都较高时)指示图像中更可能发生分裂的位置。一旦事件分数超过阈值,成像速度就会增加以详细捕获分裂事件。一旦分数降低到第二阈值,显微镜就会切换到低速成像,以避免将样品暴露在过多的光线下。
研究人员对表达线粒体靶向荧光标记的细胞进行了 EDA。在每次 EDA 测量期间,网络平均识别出细菌分裂的前体九次。这将成像速度从慢速(0.2 帧/秒)切换到快(3.8 帧/秒),平均持续 10 秒,从而实现 18% 帧的快速成像。他们指出,许多位点积累了 DRP1,但并未导致分裂。这些站点没有触发网络,这证明了其区分感兴趣事件的能力。
为了进行比较,该团队还以恒定的慢速和快速速度收集图像。与固定速率快速成像相比,EDA 造成的样品光漂白较少,从而能够对每个样品进行更长时间的观察,并增加捕获罕见线粒体分裂事件的几率。在某些情况下,样品在缓慢成像阶段从光漂白中恢复,从而实现更高的累积光剂量。
虽然 EDA 的漂白程度高于持续慢速成像,但许多 EDA 会话达到 10 分钟,且样品健康状况并未降低。研究人员还发现,EDA 更好地解决了分裂之前的收缩,以及导致裂变的膜状态的进展,如快速图像突发所捕获的那样。
“智能显微镜的潜力包括测量标准采集会遗漏的内容,”Manley 解释道。 “我们捕获更多事件,测量更小的收缩,并且可以更详细地跟踪每个部门。”
检测细菌分裂
接下来,研究人员使用 EDA 研究细菌中的细胞分裂 C. 新月形。 细菌细胞周期发生在数十分钟的时间内,这给活细胞显微镜带来了独特的挑战。他们以 6.7 帧/小时的慢速成像速度、20 帧/小时的快速成像速度或通过 EDA 切换的可变速度收集数据。
研究小组发现,为线粒体收缩开发的事件检测网络可以识别细菌分裂的最后阶段,而无需额外的训练——这可能是由于收缩形状的相似性和功能相似的分子标记的存在。
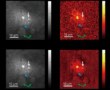
改进的显微镜技术使活细胞的灵敏度提高了七倍
同样,与恒定的快速成像相比,EDA 减少了光漂白,并且与恒定的慢速成像相比,测量的收缩平均直径明显更小。 EDA 能够对整个细胞周期进行成像,并提供使用固定成像速度难以捕获的细菌细胞分裂的细节.
曼利告诉 物理世界 该团队还计划训练神经网络来检测不同类型的事件,并使用这些事件来引发不同的硬件响应。 “例如,我们设想利用光遗传学扰动来调节细胞分化关键时刻的转录,”她解释道。 “我们还考虑使用事件检测作为数据压缩的一种手段,选择存储或分析与给定研究最相关的数据片段。”
- 为了使研究人员能够在各种显微镜上实施 EDA,该团队提供了控制框架作为 开源插件 用于微管理器软件。