质子治疗可以向肿瘤靶标提供高度适形的剂量分布,同时最大限度地减少对靶体积外组织的剂量。 制定实现这一优势的治疗计划是剂量师和医学物理学家的首要任务。
质子以与 X 射线(另一种类型的外照射放射疗法)完全不同的方式沉积剂量。 当质子到达其轨迹的末端时,其能量转移到组织的速率——其线性能量转移 (LET),以 keV/µm 表示——增加。
相对生物学有效性 (RBE) 捕捉了增加 LET 的生物学意义,并且固定的 RBE 值 1.1 通常应用于临床质子治疗。 但质子 RBE 取决于许多其他因素,包括临床终点、组织类型、分次方案、患者特异性放射敏感性、物理剂量和实验测量中的不确定性。 因此,在质子治疗中使用固定的 RBE 值可能低估了高 LET 位置的 RBE,这可能导致辐射诱发毒性的风险增加。
尽管如此,LET 与 RBE 密切相关,并且是确定质子治疗中可变 RBE 的关键因素。 因此,研究人员正在研究在治疗计划期间计算和评估 LET 的方法。 然而,这些生物治疗计划工具是有限的,并且在进一步开发和研究它们之前,诊所必须确定自己的治疗计划实践,以最大限度地减少目标体积之外的 LET,说 奥斯汀法夫特, 医学物理学家 圣裘德儿童研究医院 在田纳西州。
“如何影响 [LET 分布] 是一个活跃的研究领域,并且有一些很棒的方法正在开发中,”Faught 解释道。 “我们面临的问题是,如果没有内部开发的定制软件或通过供应商提供的应用程序的特殊研究版本,这些东西就不容易获得……[并且]很少有研究为我们应该瞄准的目标提供定量指导。”
治疗计划策略
为了朝着基于 LET 的光子治疗计划评估和优化迈进,Faught 和他的团队对计划策略进行了调查,这些计划策略可供临床团队用于调强质子治疗 (IMPT)。 他们的研究报告在 应用临床医学物理学杂志, 为质子治疗计划者介绍了一些指南。 “我们想研究一些现成的治疗计划技术,以及它们如何影响 LET,”Faught 解释说。
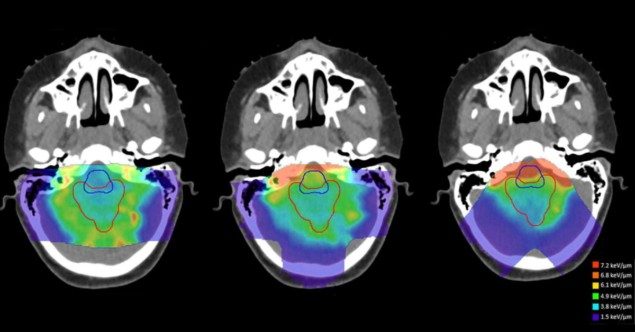
研究人员评估了剂量加权 LET (LETd) 在应用于圆柱形水模型和四个小儿脑肿瘤病例的八种基于前向的治疗计划方法之间(Faught 指出,辐射引起的毒性是团队的重点领域)。 他们将这些计划策略与使用相对侧梁的计划(对于模型)或原始临床计划(对于患者)进行了比较,使用蒙特卡罗二次计算来评估剂量和 LETd.
研究人员发现,治疗野的几何形状是影响高 LET 区域位置的最大因素。 减轻与高 LET 相关的生物学不确定性的潜在影响d,他们建议治疗计划者在治疗光束之间使用大的交叉角度,并避免在关键结构附近立即停止的光束。
“这是个好消息,因为这意味着仔细选择治疗区域的数量及其相对于附近健康组织的方向是有效的,”Faught 说。 “通过一些有意识的、预先的想法,这是所有治疗计划者在计划过程中都可以考虑的事情。”
研究人员还发现,使用范围移位器可显着降低平均 LETd 在临床靶区。 因此,他们建议谨慎使用范围移位器和现场放置限制的替代策略,并且仅当诊所可以计算出产生的 LET 时d 评估备选规划策略。
由于该研究的样本量较小,研究人员无法确定 LET 的明确趋势d 临床病例的变化。 他们没有评估 LET 变化与肿瘤控制或正常组织并发症概率变化之间的关系。
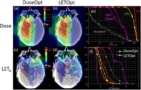
基于 LET 的计划优化质子治疗
虽然每种计划方法对高 LET 区域的影响不大,但 Faught 表示,重要的是要认识到团队的治疗计划策略和建议是基于证据的,并且可以很容易地应用于临床实践。
“我希望其中一个收获是,作为一个领域,我们将受益于允许在治疗计划系统内计算 LET 的商业工具。 更好的是,我们希望有办法在考虑 LET 的情况下进行优化。 在这些工具被更广泛地使用之前,这项研究是一个很好的桥梁,”Faught 说。