粒子疗法——使用质子束或重离子束进行癌症治疗——与传统的基于光子的放射疗法相比,可提供高度适形的剂量输送并更好地保护正常组织。 但对于长期癌症幸存者来说,辐射诱发继发性癌症(SC)的风险很重要,在选择治疗方式时应予以考虑。
由于质子和碳离子疗法等新疗法缺乏流行病学数据,一个团队领导了 GSI 亥姆霍兹重离子研究中心 正在开发一个模型来比较粒子治疗方式之间的 SC 风险。 该模型,描述为 安东尼娅·赫夫纳格尔 和同事在 医学物理学,最终可以纳入治疗计划系统中,将 SC 风险作为额外的优化标准。
致命事件与致癌事件
SC 风险模型通常通过考虑细胞杀死(导致癌症抑制)和细胞转化(诱导最终导致癌症的突变)之间的平衡来发挥作用。 受照射体积发生癌症的概率是使用线性二次 (LQ) 模型定义的,该模型提供了细胞存活率和传递的光子剂量之间的简单关系。
在这项研究中,研究人员使用局部效应模型(LEM)来预测粒子治疗后 SC 诱导的相对生物有效性(RBE)。 为了解释粒子辐射 RBE 的增加,他们用 LEM 预测的离子束 LQ 参数替换了风险模型中的光子 LQ 参数。 他们的方法的一个关键特点是在细胞杀伤和癌症诱导方面都使用了 LEM。

“LEM 的双重使用反映了决定 SC 发育的两个主要过程之间的竞争,即细胞转化和细胞杀伤,”资深作者解释道 迈克尔·舒尔茨。 “随着剂量和/或有效性的增加,细胞杀伤可以抑制转化细胞的活力。 这导致了一种复杂的相互作用,不能简单地通过一步程序来反映。”
为了调查哪些因素会影响 SC 风险,研究人员使用 TPS TRiP98 规划系统根据理想的几何形状生成生物优化的碳离子和质子治疗计划。 该计划用单束粒子束或两束相对的粒子束照射 4x4x4 厘米的目标,目标前面有一个 4x4x1 厘米的危及器官 (OAR)。 由于用作 LEM 输入的光子 LQ 参数的不确定性,他们估计了质子与碳离子的风险比,而不是单个风险值。
对于这些理想化的设置,该模型没有表现出对质子或碳离子的明显偏好,但揭示了对各种参数的复杂依赖性。 碳离子横向散射的减少导致 SC 风险低于入口通道中的质子。 然而,由于碎片尾部,碳离子在靶标后面沉积了更高的剂量,增加了碳离子照射后肿瘤后面 OAR 的 SC 风险。
对于单束计划,碳离子的总 SC 风险大约是质子的 1.5 倍。 对于两个相对的光束,质子的总 SC 风险高出 1.16 倍,尽管这在很大程度上取决于假设敏感体积相对于目标体积的空间位置。
组织放射敏感性(对光子)对 SC 风险比有重大影响,抗辐射 OAR 受益于碳离子治疗,敏感 OAR 受益于质子束。 相比之下,分割方案对预期风险值影响不大。
患者几何形状
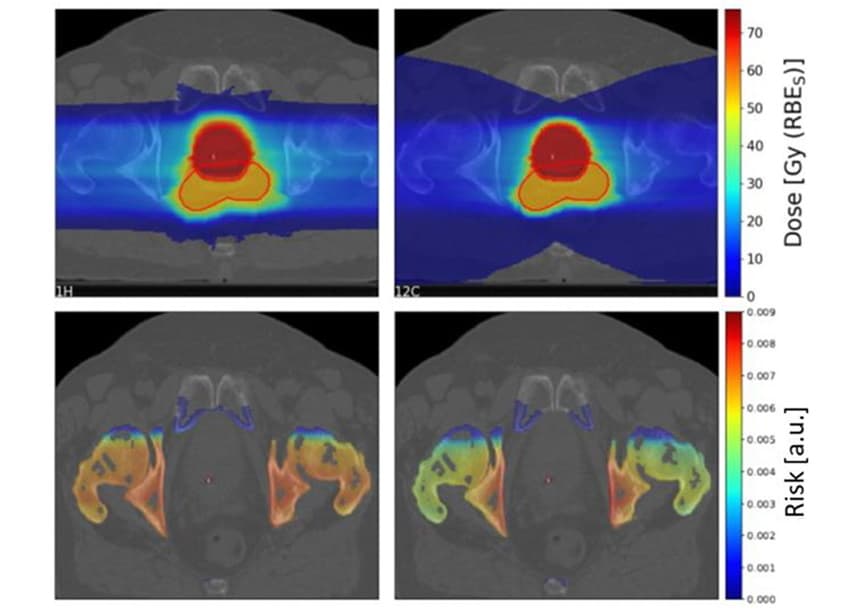
为了调查临床情况,Scholz 及其同事评估了 10 名先前在卡罗林斯卡大学医院接受光子放射治疗的前列腺癌患者的 SC 风险。 他们使用两个横向相对的扫描质子和碳离子场为患者制定了治疗计划。
如前所述,碳离子的碎片尾部导致目标后面出现一个大的低剂量区域。 然而,高剂量目标区域对于碳离子来说比质子计划更保形。
研究小组计算了 10 名患者的 1.19 个 OAR(膀胱、直肠、骨骼和皮肤)的质子与碳离子 SC 风险比。 对于骨骼和皮肤,质子计划产生的 SC 风险略高于碳离子计划,骨骼和皮肤的中位风险比分别为 1.06 和 0.68。 然而,对于膀胱和直肠,质子计划可显着降低 SC 风险,膀胱和直肠的风险比分别为 0.49 和 XNUMX。
研究人员得出的结论是,通过该模型获得的见解可以帮助优化未来的治疗方法。 目前,相对风险模型主要适合作为比较不同患者群体的不同治疗方案的工具。 但 Scholz 指出,将此类模型纳入个体患者的治疗计划中会很简单。

碳离子网格疗法保护健康组织
“它只需要使用分别代表细胞杀死和细胞转化过程的两个不同的生物参数集来运行给定剂量分布的规划,”他解释道。 “然后,只需要使用标准数学工具对生成的 3D 效果分布进行一些后处理,即可得出相应的风险比分布。”
他说,下一步是通过与临床数据比较来验证模型。 “由于目前这些数据很少,因此下一步重要的一步是将该方法扩展到包括光子治疗,并确定质子与光子以及碳离子与光子的相应风险比,”Scholz 说道。 物理世界.