三阴性乳腺癌 (TNBC) 是一种侵袭性亚型,与早期转移性复发和较差的患者预后相关。 肿瘤表达上皮-间质转化的分子标志物,但其在体内自发性 TNBC 转移过程中的要求仍不完全清楚。
科学家从 约翰霍普金斯大学医学院 已经确定了附着在初始肿瘤上的癌细胞与扩散形成远处肿瘤的癌细胞之间的显着分子变异。
Andrew Ewald 博士是弗吉尼亚 DeAcetis 基础科学研究教授和约翰霍普金斯大学医学院细胞生物学系主任,他说, “我们长期以来一直需要新的三阴性乳腺癌治疗目标和选择 癌症. 这些癌症通常在诊断后三年内复发,而用于其他乳腺癌的治疗通常不适用于三阴性。”
科学家们对小鼠模型和人体组织进行了研究。 这种形式的癌症特别致命,因为它的表面缺乏与激素黄体酮和 雌激素,以及促癌蛋白 Her2-neu。 最多 乳腺癌 今天的治疗针对这些标记物,使它们对三阴性肿瘤患者无效。
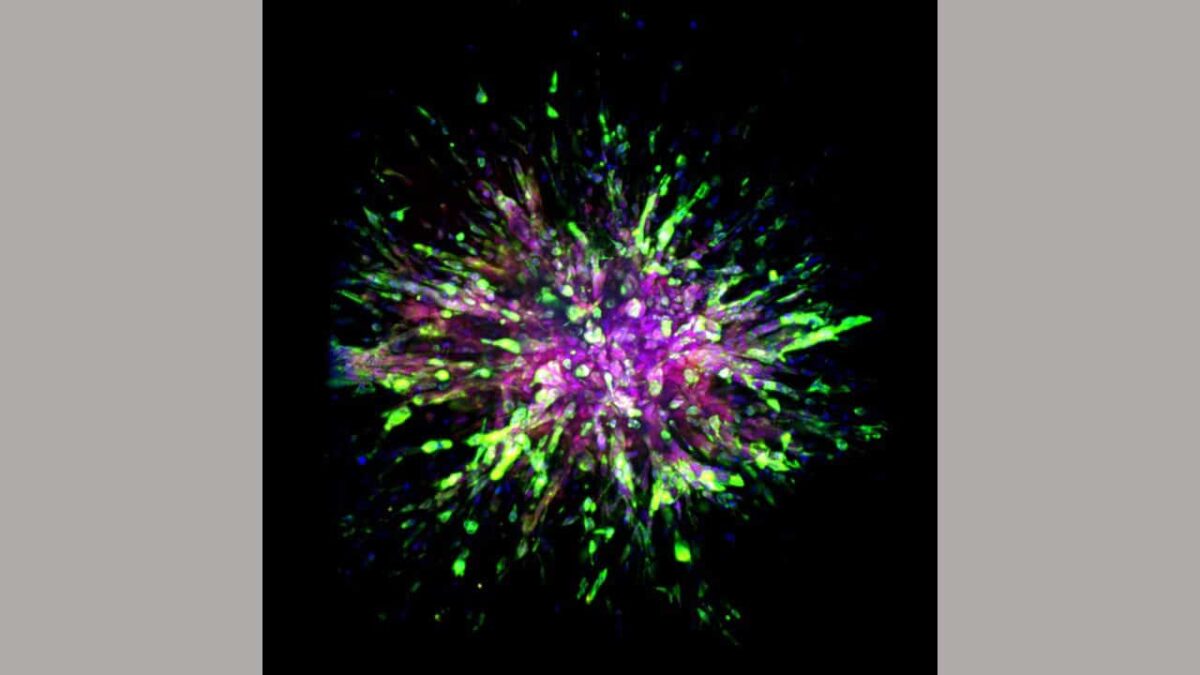
在这项研究中,科学家们仔细观察了三种不同类型的细胞:小鼠模型、植入小鼠的人类癌症和样本之间的初始或原发性三阴性乳腺癌部位与其扩散区域或转移部位之间的分子差异取自八名患者的原发性和转移性组织。
使用诸如 机器学习、细胞成像和生化分析,科学家们确定了原发性和转移性癌症基因组表达模式之间的差异。
埃瓦尔德说, “我们研究的坏消息是来自转移部位的细胞针对迁移和抵抗治疗进行了超级优化。 好消息是,我们发现了几种称为转录因子的蛋白质,这些细胞需要这些蛋白质来应对在转移部位迁移和繁衍的挑战。 我们或许能够设计出针对这些转录因子的新疗法。”
科学家们注意到植入人类三阴性乳腺癌肿瘤的小鼠或被改造为患有该疾病的小鼠的小鼠的细胞中有几个独特的特征。 最重要的是,他们发现三阴性乳腺癌细胞侵入身体另一部分的其他组织后,这些细胞获得了两种细胞特性:更好的运动和存活。
为了实现这一点,乳腺癌细胞获得了波形蛋白细胞骨架蛋白,这提高了所谓的间充质细胞迁移和产生新细胞的能力。 间充质细胞是一种通常存在于骨骼和 骨髓.
一种称为钙粘蛋白的蛋白质的产生为三阴性乳腺癌细胞提供了生存益处。 这种蛋白质通常存在于排列在导管和器官覆盖物上的上皮细胞中,并经常自我更新。
当三阴性乳腺癌细胞获得这种生存和迁移特性时,科学家将它们的细胞状态归类为所谓的混合上皮间充质 (EMT) 细胞。
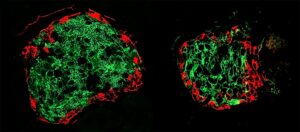
在约翰霍普金斯金梅尔癌症中心融合研究所联合主任、定量科学部主任和副主任 Elana Fertig 博士的帮助下,科学家们仔细观察了参与混合 EMT 状态的分子。 他们还跟踪了细胞分析中单个细胞的分子模式,这些分析模拟了从原发性肿瘤侵入并在转移部位形成集落。
研究人员采用机器学习技术来识别每个细胞表达的模式 RNA,参与蛋白质合成的DNA的亲戚。 研究人员发现,大多数转移性细胞转变为混合 EMT 状态,这种状态更具迁移性和弹性。 然后,科学家们检查了来自同一患者转移部位的原发性肿瘤和组织,以验证来自 XNUMX 名三阴性恶性肿瘤患者样本中的相似状态。
在分子水平上,大多数转移性细胞产生五种称为转录因子的蛋白质(Grhl2、Foxc2、Zeb1、Zeb2 和 Ovol1),它们促进了参与癌细胞侵袭或集落形成的蛋白质的制造。
埃瓦尔德 说过, “转移性肿瘤和原发性肿瘤之间的分子差异可能是转移性肿瘤细胞对当前治疗如此耐药的原因。”
科学家们现在正在研究阻断转录因子基因或其产生的蛋白质以阻止转移性癌症生长的方法,以及在其他癌症中是否会发生相同的分子和细胞变化,例如结肠、肾上腺、胃和小肠中的癌症。
杂志参考:
- Eloise M. Grasset、Matthew Dunworth 等人。 三阴性乳腺癌转移涉及复杂的上皮间质转化动力学,需要波形蛋白。 科学转化医学。 DOI: 10.1126/scitranslmed.abn7571