علاج السرطان بالإشعاع يمكن أن يحفز الاستجابة المناعية للجسم ويمنع نمو الورم، ولكنه يمكن أن يقلل أيضًا من مستوى الخلايا الليمفاوية، وخلايا الدم البيضاء المرتبطة بالاستجابة المناعية، مما يؤدي إلى ضعف السيطرة على الورم وسوء التشخيص. ترتبط شدة قلة اللمفاويات الناجمة عن الإشعاع بالجرعة التي يتم توصيلها إلى خلايا الدم والخلايا الليمفاوية المنتشرة. على هذا النحو، فإن تقليل الجرعة إلى القلب والدم المحيطي والأعضاء اللمفاوية يمكن أن يساعد في تقليل هذا التأثير الضار.
لمزيد من التحقيق في هذه النظرية، أنتجي جالتس و عبد الخالق حمي من جامعة TU Dortmund، اكتشف ما إذا كان العلاج الإشعاعي FLASH - الإشعاع الذي يتم تقديمه بمعدلات جرعات عالية جدًا - يمكن أن يقلل من مستوى استنفاد الخلايا المناعية أثناء العلاج بالبروتون لمرضى سرطان الدماغ.
"إن الآلية البيولوجية وراء تأثير FLASH الملحوظ بمعدلات جرعات عالية ليست مفهومة بالكامل بعد. ومع ذلك، فإن إحدى النظريات المقترحة هي الفرضية المناعية، التي تشير إلى أن توصيل الجرعة اللحظية من إشعاع فلاش يقلل بشكل كبير من استنفاد الخلايا الليمفاوية المنتشرة عن طريق تقليل وقت التعرض. "في دراستنا، أظهرنا أن العلاج ناقص التجزئة وتوصيل الجرعة السريعة أنقذ الخلايا المناعية بما يصل إلى 27 مرة مقارنة بخطة العلاج التقليدية باستخدام المسح باستخدام شعاع قلم البروتون المجزأ."
استخدم جالتس وهامي أ نموذج قياس تدفق الدم لمحاكاة الجرعة للخلايا الليمفاوية المنتشرة أثناء العلاج بالبروتونات التقليدية والمعتمدة على FLASH (IMPT) لورم الدماغ. يحاكي نموذج تسليم الشعاع الديناميكي خطة العلاج المجزأة IMPT مع الأخذ في الاعتبار التباين الزماني المكاني لمعدل الجرعة لكل حزمة قلم رصاص بروتون واحدة. ويشير هامي إلى أن النموذج يشتمل على معلمات توصيل واقعية من السيكلوترونات المتاحة تجاريًا.
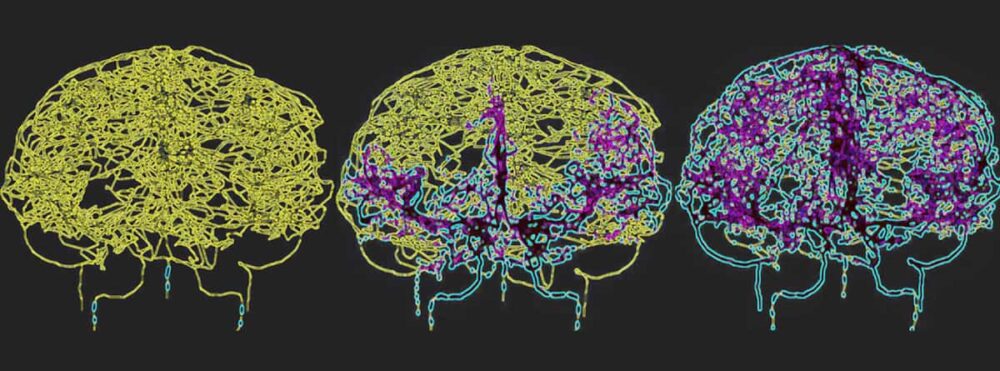
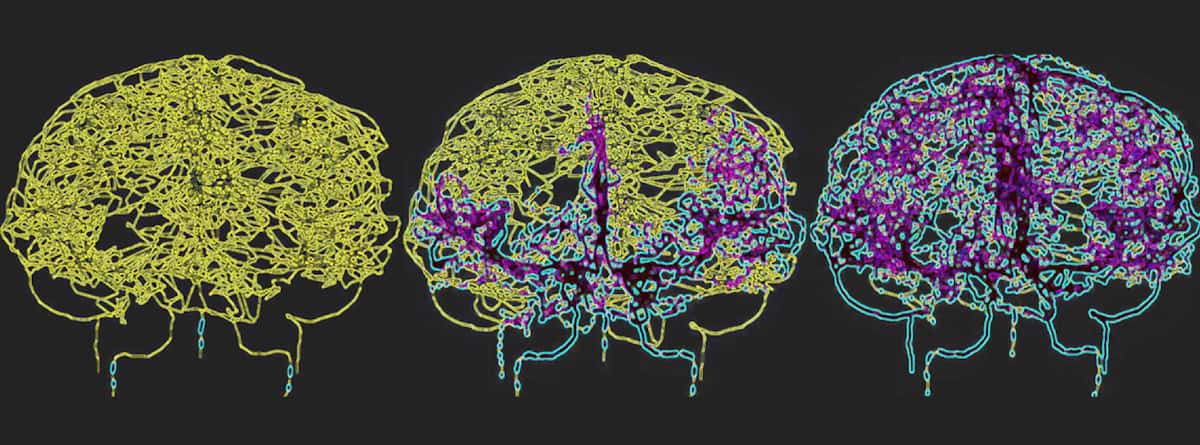
لعكس الدورة الدموية بدقة في الدماغ البشري، رسم جالتس وهامي خريطة للأوعية الدموية مباشرة من صور تصوير الأوعية الدموية للدماغ بالرنين المغناطيسي. واستخدموا النموذج الوعائي الدماغي الناتج، والذي تضمن 465 وعاءً دمويًا و8841 فرعًا فرديًا للأوعية الدموية، لمحاكاة دوران الخلايا المناعية داخل مجرى الدم.
أنشأ الباحثون خطط علاج واقعية لـIMPT للورم الأرومي الدبقي، باستخدام أربعة حزم بروتونية متساقطة ومعلمات التسليم ذات الصلة سريريًا. ثم قاموا بحساب مجالات الإشعاع المتغيرة بمرور الوقت التي يتعرض لها الدم المنتشر أثناء تقديم خطط العلاج بالبروتون والجرعة المتراكمة بعد العلاج، وأبلغوا عن النتائج التي توصلوا إليها في الفيزياء في الطب وعلم الأحياء.
الورم الأرومي الدبقي هو الشكل الأكثر فتكا من سرطان الدماغ وعلاجه بالعلاج الإشعاعي يمكن أن يسبب قلة اللمفاويات الناتجة عن الإشعاع لفترات طويلة. يقول هامي: "من خلال نمذجة النظام الوعائي الدماغي أثناء توصيل الإشعاع، نأمل في الحصول على رؤى أعمق حول كيفية تأثير العلاج الإشعاعي على الاستجابة المناعية لدى هذه المجموعات من المرضى، مما قد يؤدي إلى تحسين الاستراتيجيات العلاجية".
مقارنات الخطة
قام جالتس وهامي بفحص أربعة سيناريوهات علاجية: IMPT FLASH بجزء واحد قدره 22.3 غراي؛ FLASH ناقص التجزئة باستخدام قسمين 14.6 غراي وخمسة كسور 8 غراي؛ وIMPT التقليدية باستخدام اثنين وثلاثين جزءًا من 2 غراي. وفي كل خطة علاجية، قاموا بتقييم تأثير قياس الجرعات على الخلايا الليمفاوية المنتشرة وقدروا السمية الإشعاعية الناتجة.
كشفت الرسوم البيانية للحجم والجرعة أن العلاج الإشعاعي FLASH قلل بشكل كبير من نسبة الخلايا المشععة مقارنة بمعدل الجرعة التقليدية IMPT. خلال جزء العلاج الأول، قامت جميع أنظمة FLASH الثلاثة بإشعاع حوالي 1.52% من حجم الدم المنتشر، في حين قامت تقنية IMPT التقليدية بإشعاع 2.18%. أدت خطط FLASH الناقص التجزئة، والتي تم تقديمها على جزئين أو خمسة أجزاء، إلى زيادة هذا الحجم المشعع إلى 3.01% و7.35% على التوالي، في حين تعرض IMPT التقليدي 42.41% من الدم المحيطي للإشعاع.
بعد ذلك، قام الباحثون بفحص مستوى الخلايا الليمفاوية المنتشرة التي تلقت جرعة لا تقل عن 7 cGy - وهي العتبة التي تسبب استنزاف 2٪ في عدد الخلايا الليمفاوية - خلال فترة العلاج بأكملها. بعد إكمال عملية IMPT التقليدية، تلقت 25.65% من الخلايا الليمفاوية المنتشرة جرعة لا تقل عن 7 cGy. بالنسبة لعلاجات FLASH الفردية والثنائية والخمسية، كانت الكميات التي تلقت أكثر من عتبة الجرعة هذه 1.21% و2.30% و5.14% على التوالي.
كانت أحجام الخلايا الليمفاوية المنتشرة التي تتلقى جرعات تزيد عن 100 cGy، والتي تسبب استنفادًا بنسبة 30٪، 0.77٪ و1.28٪ و2.09٪ للـ FLASH أحادي وثنائي وخمسة أجزاء، على التوالي، و0.10٪ خلال IMPT التقليدي.
قام جالتس وهامي أيضًا بدراسة استجابة الخلايا الليمفاوية CD4+ وCD8+، والتي لها توزيعات مختلفة في الدم المحيطي، لسيناريوهات التشعيع المختلفة. بالنسبة لكلا النوعين من الخلايا الليمفاوية، كان قتل الخلايا بعد الكسر الأول 0.66%، 0.62%، 0.32% و 0.08% للـ FLASH المفرد والثنائي والخمسة، وIMPT التقليدي، على التوالي.
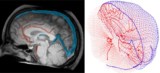
يحدد النموذج الحسابي جرعة الدم أثناء العلاج الإشعاعي
بعد العلاج الكامل، كان النضوب في الخلايا الليمفاوية 1.02% و1.56% لكسور المعالجة الثنائية والخمسة، على التوالي، و2.14% للIMPT التقليدي. توضح هذه النتائج أن العلاج بالبروتونات FLASH يحفظ الخلايا المناعية المنتشرة أثناء العلاج داخل الجمجمة، حيث يقلل جزء واحد من FLASH من معدل الاستنفاد بنسبة 70٪ تقريبًا مقارنة مع IMPT التقليدي.
يحكي هامي عالم الفيزياء أنهم يقومون الآن بتوسيع النموذج ليشمل سرطانات الرأس والرقبة. "علاوة على ذلك، نحن نستكشف طرق توصيل FLASH المختلفة وتأثيرها على استنفاد جهاز المناعة، مع التركيز بشكل خاص على علاج FLASH المطابق الذي يعتمد على تعديل الطاقة السلبي الخاص بالمريض،" يوضح. "يتمتع نموذج التسليم هذا بالقدرة على توفير عدد أكبر من الخلايا الليمفاوية المنتشرة مقارنةً بتسليم FLASH عبر إطلاق النار."
- محتوى مدعوم من تحسين محركات البحث وتوزيع العلاقات العامة. تضخيم اليوم.
- PlatoData.Network Vertical Generative Ai. تمكين نفسك. الوصول هنا.
- أفلاطونايستريم. ذكاء Web3. تضخيم المعرفة. الوصول هنا.
- أفلاطون كربون، كلينتك ، الطاقة، بيئة، شمسي، إدارة المخلفات. الوصول هنا.
- أفلاطون هيلث. التكنولوجيا الحيوية وذكاء التجارب السريرية. الوصول هنا.
- المصدر https://physicsworld.com/a/flash-irradiation-spares-immune-cells-during-proton-therapy/
- :لديها
- :يكون
- :ليس
- $ UP
- 1
- 10
- 100
- 14
- 160
- 2%
- 22
- 25
- 27
- 35%
- 7
- 8
- a
- متراكم
- بدقة
- بعد
- الكل
- تقريبا
- أيضا
- an
- و
- هي
- حول
- AS
- تقييم
- أسوشيتد
- At
- متاح
- على أساس
- شعاع
- وراء
- دم
- على حد سواء
- دماغ
- سرطان الدماغ
- الفروع
- لكن
- by
- محسوب
- CAN
- السرطان.
- سبب
- الأسباب
- الخلية
- خلايا
- تعميم
- تداول
- انقر
- تجاريا
- مقارنة
- الانتهاء
- النظر
- مراقبة
- تقليدي
- استطاع
- خلق
- أعمق
- تم التوصيل
- التوصيل
- شرح
- يحدد
- مختلف
- مباشرة
- توزيع
- التوزيعات
- جرعة
- جرعات
- أثناء
- ديناميكي
- كل
- تأثير
- طاقة
- كامل
- متساو
- توازن
- مقدر
- توسيع
- ويوضح
- استكشاف
- استكشاف
- مكشوف
- تعرض
- FAST
- مجال
- النتائج
- الاسم الأول
- خمسة
- Flash
- تدفق
- تركز
- متابعيك
- في حالة
- النموذج المرفق
- أربعة
- جزء
- تبدأ من
- بالإضافة إلى
- تماما
- إضافي
- ربح
- مجموعات
- التسويق
- يملك
- he
- قلب
- مساعدة
- مرتفع
- أمل
- كيفية
- لكن
- HTTPS
- الانسان
- صورة
- صور
- جهاز المناعة
- التأثير
- تحسن
- ضريبة
- in
- حادث
- تتضمن
- شامل
- يدمج
- زيادة
- فرد
- معلومات
- رؤى
- إلى
- بحث
- قضية
- IT
- JPG
- قتل
- قيادة
- الأقل
- اليسار
- مستوى
- لينكدين:
- يعد
- ماكس العرض
- آلية
- دواء
- طرق
- التقليل
- نموذج
- تصميم
- تصميم
- الأكثر من ذلك
- أكثر
- mr
- ملاحظة
- الآن
- of
- on
- ONE
- جاكيت
- or
- لنا
- خارج
- على مدى
- المعلمات
- خاص
- سلبي
- المرضى
- فيزياء
- عالم الفيزياء
- خطة
- خطط
- أفلاطون
- الذكاء افلاطون البيانات
- أفلاطون داتا
- فقير
- سكان
- محتمل
- يحتمل
- نسبة
- المقترح
- المعالجة بالإشعاع
- معدل
- الأجور
- واقعي
- تلقى
- يستلم
- تخفيض
- عقار مخفض
- يقلل
- تقليص
- تعكس
- ذات الصلة
- التقارير
- الباحثين
- على التوالي
- استجابة
- مما أدى
- أظهرت
- حق
- s
- يقول
- مسح
- سيناريوهات
- مخططات
- أظهرت
- بشكل ملحوظ
- عزباء
- بداية
- حفز
- استراتيجيات
- مجرى
- مدروس
- دراسة
- هذه
- وتقترح
- نظام
- يروي
- من
- أن
- •
- من مشاركة
- then
- نظرية
- علاج
- تشبه
- هم
- ثلاثة
- عتبة
- عبر
- صورة مصغرة
- الوقت
- مرات
- إلى
- معالجة
- علاج
- العلاجات
- صحيح
- اثنان
- أنواع
- فهم
- جامعة
- مستعمل
- استخدام
- مختلف
- سفينة
- حجم
- مجلدات
- وكان
- we
- كان
- متى
- سواء
- التي
- في حين
- أبيض
- مع
- في غضون
- العالم
- حتى الآن
- زفيرنت