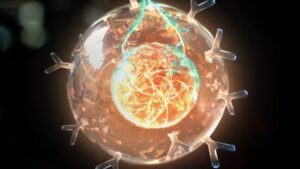
يمكن للمحقنة الجزيئية الصغيرة ذات الأصول الغريبة أن تصلح واحدة من أكثر المشاكل الشائكة في الطب: إيصال الأدوية إلى وجهاتها المستهدفة داخل الجسم. المصدر؟ تعيش البكتيريا في أمعاء الحشرات.
تبدو الماكينة النانوية المحملة بزنبرك أشبه بسفينة صاروخية. بمجرد أن يرسو ، ينطلق الحاقن لأسفل لاختراق الخلايا وتقديم حمولات ثمينة.
عندما يتم تطويرها بشكل أكبر ، يمكن للحاقنات الجزيئية نقل العلاجات المناعية للسرطان فقط إلى الخلايا السرطانية ، وتجنب الخلايا السليمة والحد من الآثار الجانبية. يمكن للنظام أيضًا أن ينفق نفقًا بأمان إلى الدماغ - وهو عضو معروف بصعوبة وصول الأدوية إليه - يحتمل أن ينقل البروتينات التي يمكن أن تساعد في تشخيص السكتات الدماغية ومرض الزهايمر والاضطرابات العصبية الأخرى.
نشرت في الطبيعة, الحاقن مستوحى من المملكة البكتيرية. تشانغ ليس غريباً على استكشاف المادة المظلمة للحيوية. اشتهر Zhang بعمله الأساسي في تحرير الجينات CRISPR-Cas9 ، والذي نشأ كنظام دفاع بكتيري ضد الفيروسات ، وقد أخذ تلميحات منذ فترة طويلة من التطور إلى صياغة الجيل التالي من عجائب التكنولوجيا الحيوية.
لكن هذه المرة ، جلب فريقه متعاونًا آخر إلى هذا المزيج: AlphaFold.
من تطوير شركة DeepMind ، تصدرت منظمة العفو الدولية عناوين الصحف لقدرتها الخارقة على ذلك توقع هياكل البروتين. باستخدام الأداة ، قام الفريق بتحسين جزء أساسي من الحاقن البكتيري ، مما جعله يتحول من هدفهم المفضل - خلايا الحشرات - إلى مجموعة متنوعة من الفئران والبشر.
أظهرت العديد من دراسات إثبات المفهوم في كل من الخلايا المستنبتة والفئران براعة الحقنة الجديدة. قامت إحدى التجارب بإيصال مادة سامة إلى الخلايا السرطانية دون الإضرار بالآخرين. قام شخص آخر بحقن Cas9 - "مقص" البروتين في أداة تحرير الجينات CRISPR - في الخلايا البشرية المستزرعة وتحرير الجينات المستهدفة بكفاءة عالية.
هذه القدرة على التوصيل والتشغيل تجعل النظام قوة توصيل. "نظهر أنه بمجرد وضع علامة على البروتين ، يمكننا تحميل أنواع مختلفة من البروتينات في هذه الإبر ،" محمد تشانغ.
"امتلاك القدرة على إيصال بروتينات معينة إلى أنواع خلايا معينة من شأنه أن يوفر إمكانات هائلة للبحث في علوم الحياة ، وكذلك لعلاج الأمراض ،" محمد تشارلز إريكسون والدكتور مارتن بيلهوفر في ETH Zürich ، الذين لم يشاركوا في العمل.
يضع النظام ، عند دمجه مع الآخرين ، الأساس لمجموعة أدوات قوية للخلط والمطابقة لكل من البحث والطب. على الرغم من أنه قادر حاليًا على نقل البروتينات فقط ، إلا أن اختيار المحاقن الجزيئية الطبيعية الأخرى يمكن أن يوسع النظام إلى الحمض النووي والجزيئات الحيوية الأخرى.
قال تشانغ: "ما زالت الأيام الأولى لهذا الأمر كتقنية".
كوابيس التسليم
تخيل تسليم الأدوية باسم DoorDash. تريد أن يأتي طلبك إليك فقط ، وليس إلى جيرانك ، وأن يكون الطعام سليمًا.
تبدو تافهة ، لكنها مهمة يصعب تحقيقها بالأدوية والعلاج الجيني. تدخل الأدوية على شكل أقراص أو لصقات أو إبر في الوريد - مثل أكياس المحلول الملحي أو العلاجات الكيميائية - إلى مجرى الدم. والنتيجة هي أنها تغمر أعضاء وأنسجة مختلفة وتتسبب في كثير من الأحيان في آثار جانبية.
في تناقض صارخ ، هناك مشكلة أخرى تتمثل في أن بعض الأدوية لا يمكنها اختراق أهدافها. الخلايا عبارة عن حصون محاطة بغشاء دهني مزدوج الطبقات ، مع آليات تقوم أحيانًا ببصق دخيل غير مرغوب فيه. عندما يكون هؤلاء الدخلاء عناصر علاج جيني أو بروتينات علاجية ، فإن نظام الدفاع للخلايا يصبح صداعًا شديدًا.
ابتكر العلماء طرقًا لتجاوز هذه الدفاعات. الأول هو استخدام فيروسات غير ضارة لتهريب مواد اللقاح. والأخرى هي الأغلفة النانوية الدهنية ، والتي تتكون من فقاعات دهنية صغيرة. بمجرد الاندماج مع الخلية ، "تنفجر" الفقاعات وتحرر الحمولة. في حين أن هذه الأنظمة أساسًا للهندسة الوراثية ، إلا أنها ليست دقيقة كما نرغب. بالعودة إلى تشبيه DoorDash ، ستمنحك الغطاس بعضًا من طلباتك - بينما تجلب الباقي إلى جيرانك المطمئنين وغير الراغبين.
إلهام جرثومي
في الدراسة الجديدة ، تخلص تشانغ من كتاب اللعبة وخرج تمامًا من الصندوق. استخدم هو وزميله جوزيف كريتز حقنة جزيئية صنعها التطور.
المورد غير المتوقع هو بكتيريا ضيائية بيولوجية تسمى Photorhabdus asymbioticaالذي يعيش في أمعاء الحشرات. وهي تأتي مسلحة بشكل كبير: كل منها مزود بمحقن جزيئية دقيقة - يبلغ طولها حوالي 100 نانومتر - مع "أقدام" تمسك بالخلايا المضيفة. بمجرد الالتحام ، يدخل المكبس عبر غشاء الخلية ، ويطلق سمًا يقتل العائل - ويسمح بدوره للبكتيريا بالهروب واستعمار الخلايا الأخرى.
إن آلية السبر الخطير - التي يطلق عليها نظام الحقن المقلص ، أو CIS - بالكاد تبدو مناسبة لنظام توصيل آمن. لكن أحد الأمور الغريبة لفت انتباه الفريق: حاقنات البكتيريا عادة ما تعمل فقط مع البكتيريا الأخرى ، وليس الخلايا الحيوانية. فلماذا لا تعيد ضبط ملف فوتورابدوس حقنة لحقن الخلايا البشرية أيضًا؟
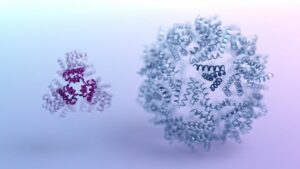
قام الفريق أولاً بشحذ جزء من الحاقن يسمى ألياف الذيل. أوضح تشانغ أن هذه "الأشياء التي تشبه اللوامس" تساعد الماكينة النانوية على الالتصاق بالخلايا. المفتاح هو مطابقة المستقبلات ، أو محطات الإرساء ، على سطح الخلايا. يحتوي كل نوع من الخلايا على عدد لا يحصى من الأرصفة الفريدة من نوعها لطابعها البيولوجي - فالخلايا العصبية ، على سبيل المثال ، لديها العديد من الخلايا التي تختلف اختلافًا كبيرًا عن تلك الموجودة في خلايا القلب. أولئك الذين ينتمون إلى كائنات حية مختلفة هم أكثر تباينًا.
لذلك ليس من المستغرب أن المحاقن ، المصممة للعمل في خلايا الحشرات ، فشلت في الخلايا البشرية. مع العلم أن ألياف الذيل هي الجوهر ، جلب الفريق متعاونًا جديدًا: AlphaFold. باستخدام الذكاء الاصطناعي ، أنشأ الفريق نموذجًا ثلاثي الأبعاد للبروتين الصعب الموجود في منطقة يوجه الحاقن نحو خلايا الحشرات.
ثم قاموا بعد ذلك بتعديل هذه المنطقة وراثيًا ، وقطعوا نهاية ألياف الذيل وإضافة قطع بروتين مختلفة لتوجيه الحاقن نحو خلايا بشرية وفئران معينة.
"أعطتنا [AlphaFold] المعلومات التي نحتاجها لوضع إستراتيجية توصيل جديدة يمكن تغييرها لاستهداف خلايا مختلفة ،" محمد كريتز.
مزج وو صل
اختبر الفريق حاقناتهم القابلة للبرمجة بعدة تجارب.
في إحداها ، قاموا بتحميل المحقنة ببروتين تسبب بمجرد حقنها في توهج الخلايا البشرية في المزرعة بلون أخضر نابض بالحياة في الظلام. تم إعادة صياغة حقنة مماثلة لتعقب الخلايا السرطانية المنقطة بمستقبلات عامل نمو البشرة (EGFR) على سطحها. وقد أدى العلاج المحمّل بالسموم إلى قتل جميع الخلايا التي تحتوي على المستقبلات تقريبًا ولكنه تجنب الآخرين. وبالمثل ، قام الفريق بسهولة بتسليم Cas9 إلى مجموعة متنوعة من الخلايا البشرية ، والتي عند تزويدها بدليل RNA قامت بتحرير الجينوم في النقاط المتوقعة.
أخيرًا ، في الاختبار النهائي ، حقن الفريق النظام في حصين الفئران. مشبعة بالبروتين الفلوري ، تتوهج الخلايا باللون الأخضر الفاتح. الأهم من ذلك ، على الرغم من أن هذه الحقن مشتقة من البكتيريا ، إلا أنها لم تحفز استجابة مناعية.
النظام ليس مثاليًا. على الرغم من كفاءته في الأنسجة المختبرة ، يأمل الفريق في توسيع نطاقه ليشمل أنواعًا مختلفة من الأنسجة ونماذج الأمراض. الهدف الآخر هو البحث عن محاقن طبيعية أخرى وتحويلها إلى مجموعة كاملة من أدوات التوصيل - في سياق مشابه لنمو كريسبر. في الوقت الحالي ، لا يحمل النظام سوى البروتينات. لكن المزيد من الهندسة يمكن أن تسمح بتسليم محدد للحمض النووي ، والحمض النووي الريبي ، والجزيئات الحيوية الأخرى ، وربما حتى التحكم في جرعاتها.
قال تشانغ: "لا يزال هذا النهج مبكرًا ، لكنني أعتقد أنه من المهم حقًا استكشاف [قدرة النظام] لتكون قادرًا على علاج العديد من الأنواع المختلفة من الأمراض التي تؤثر على صحة الإنسان".
حقوق الصورة: جوزيف كريتز ، معهد برود لمعهد ماساتشوستس للتكنولوجيا وجامعة هارفارد ، معهد ماكغفرن لأبحاث الدماغ في معهد ماساتشوستس للتكنولوجيا
- محتوى مدعوم من تحسين محركات البحث وتوزيع العلاقات العامة. تضخيم اليوم.
- بلاتوبلوكشين. Web3 Metaverse Intelligence. تضخيم المعرفة. الوصول هنا.
- المصدر https://singularityhub.com/2023/04/04/this-amazing-molecular-syringe-could-smuggle-drugs-and-gene-therapies-into-human-cells/
- :يكون
- 100
- 3d
- a
- القدرة
- ماهرون
- التأهيل
- بنشاط
- تؤثر
- ضد
- AI
- الكل
- يسمح
- بالرغم ان
- الزهايمر
- مدهش
- و
- حيوان
- آخر
- نهج
- هي
- مسلح
- AS
- At
- الى الخلف
- بكتيريا
- حقائب
- BE
- يصبح
- أفضل
- قطعة
- الجسدي
- صندوق
- دماغ
- مشرق
- وبذلك
- واسع
- جلبت
- by
- تسمى
- CAN
- السرطان.
- الخلايا السرطانية
- قادر على
- اشتعلت
- سبب
- تسبب
- خلايا
- تشارلز
- طفل
- متلاطم الامواج
- الزميل
- الجمع بين
- تأتي
- تماما
- تباين
- مراقبة
- جوهر
- استطاع
- حرفة
- ائتمان
- ثقافة
- حاليا
- غامق
- المادة المظلمة
- أيام
- العقل العميق
- الدفاع
- نقل
- تم التوصيل
- التوصيل
- مستمد
- تصميم
- لأفضل الأماكن السياحية
- المتقدمة
- مختلف
- صعبة
- مرض
- الأمراض
- اضطرابات
- الحمض النووي
- إلى أسفل
- عقار
- المخدرات
- كل
- في وقت مبكر
- بسهولة
- الآثار
- كفاءة
- فعال
- عناصر
- الهندسة
- مسلح
- ETH
- حتى
- تطور
- مثال
- وسع
- تجربة
- شرح
- اكتشف
- استكشاف
- عين
- فشل
- للعائلات
- ألياف
- الاسم الأول
- تناسب
- فيضان
- طعام
- في حالة
- النموذج المرفق
- وجدت
- دورة تأسيسية
- تبدأ من
- إضافي
- تحرير الجين
- ولدت
- الهندسة الوراثية
- الحصول على
- منح
- هدف
- الذهاب
- يفهم، يمسك، يقبض
- أخضر
- النمو
- التسويق
- توجيه
- دليل
- الثابت
- إيذاء
- هارفارد
- يملك
- عناوين
- صحة الإنسان
- صحي
- قلب
- مساعدة
- مرتفع
- تلميحات
- أمل
- مضيف
- لكن
- HTTPS
- الانسان
- i
- أهمية
- in
- معلومات
- موحى
- معهد
- المشاركة
- IT
- انها
- JPG
- القفل
- مملكة
- معرفة
- معروف
- الحياة
- علوم الحياة
- مثل
- القليل
- حياة
- الذين يعيشون
- تحميل
- طويل
- تبدو
- صنع
- جعل
- يصنع
- القيام ب
- كثير
- مارتن
- هائل
- نطاق واسع
- مطابقة
- المواد
- أمر
- طبي
- دواء
- معهد ماساتشوستس للتكنولوجيا
- نموذج
- عارضات ازياء
- تم التعديل
- جزيئي
- الأكثر من ذلك
- طبيعي
- الطبيعة
- تقريبا
- الجيران
- جديد
- الجيل القادم
- of
- عرض
- on
- ONE
- الأمثل
- طلب
- نشأت
- أخرى
- أخرى
- في الخارج
- إصلاح
- جزء
- خاص
- بقع
- ربما
- أفلاطون
- الذكاء افلاطون البيانات
- أفلاطون داتا
- بلايستشن
- قابس
- التوصيل والتشغيل
- نقاط
- محتمل
- يحتمل
- قوي
- ثمين
- حاجة
- وتوقع
- المفضل
- المشكلة
- مشاكل
- بروتين
- البروتينات
- شجاعة
- وضع
- نطاق
- منطقة
- الافراج عن
- بحث
- مورد
- استجابة
- REST
- نتيجة
- RNA
- رسوم الصاروخ
- خزنة
- بسلام
- قال
- علوم
- يبدو
- باكجات
- عدة
- سفينة
- اطلاق النار
- إظهار
- جانب
- مماثل
- وبالمثل
- So
- بعض
- مصدر
- محدد
- قاس
- محطات
- لا يزال
- غريب
- الإستراتيجيات
- دراسات
- دراسة
- زودت
- المساحة
- مفاجأة
- محاط
- مفاتيح
- نظام
- أنظمة
- TAG
- استغلالها
- الهدف
- الأهداف
- مهمة
- فريق
- تكنولوجيا
- تجربه بالعربي
- أن
- •
- المعلومات
- المصدر
- من مشاركة
- منهم
- تشبه
- عبر
- الوقت
- إلى
- أداة
- الأدوات
- نحو
- مسار
- علاج
- علاج
- هائل
- يثير
- منعطف أو دور
- أنواع
- نهائي
- غير متوقع
- فريد من نوعه
- غير مرغوب فيه
- us
- تستخدم
- عادة
- لقاح
- تشكيلة
- نابض بالحياة
- الفيروسات
- طرق
- حسن
- التي
- في حين
- من الذى
- كامل
- سوف
- مع
- بدون
- للعمل
- سوف
- أنت
- حل متجر العقارات الشامل الخاص بك في جورجيا
- زفيرنت