العلاج الإشعاعي الحراري هو علاج للسرطان يتم فيه استخدام ارتفاع الحرارة - تسخين الورم إلى درجة حرارة أعلى من درجة حرارة الجسم - لتعزيز فعالية العلاج الإشعاعي. يتم التعبير عن مقدار هذا التحسين كـ EQDRT، الجرعة الإشعاعية المكافئة اللازمة لتحقيق نفس التأثير العلاجي بدون تسخين.
أظهرت التجارب السريرية أن هذا النهج يمكن أن يحسن بشكل كبير نتائج العلاج في العديد من أنواع الأورام ، دون زيادة سمية الأنسجة الطبيعية. أظهرت الدراسات السابقة أيضًا أن درجة الحرارة المحققة والفاصل الزمني بين العلاج الإشعاعي وارتفاع الحرارة يؤثران على النتيجة السريرية.
لفهم هذه العملية بمزيد من التفصيل والمساعدة في تحسين العلاجات ، قام الباحثون في أمستردام UMC استخدمت النمذجة البيولوجية للتحقيق في تأثير درجة الحرارة القصوى والفاصل الزمني على EQDRT. واصفا النتائج التي توصلوا إليها في المجلة الدولية لعلم الأورام الإشعاعي، وعلم الأحياء، والفيزياء، أفادوا أن درجات الحرارة المرتفعة والفترات الزمنية القصيرة ضرورية لتحقيق أقصى قدر من التحسين العلاجي.
النموذج البيولوجي
لأداء العلاج الإشعاعي الحراري ، يستخدم الأطباء جهاز الترددات الراديوية أو الميكروويف لتسخين الورم مرة أو مرتين في الأسبوع ، إما قبل جلسة العلاج الإشعاعي أو بعدها. يتم الاحتفاظ بدرجة حرارة الورم أقل من 45 درجة مئوية لمنع تسخين الأنسجة الطبيعية ، ولكن في بعض الأحيان يمكن أن تحدث بقع ساخنة غير مرغوب فيها (ومؤلمة) ، مما يحد من مستوى الطاقة الأقصى المسموح به والذي يمكن استخدامه أثناء علاج ارتفاع الحرارة.
المؤلف الأول بترا كوك طور وزملاؤه برنامجًا لنمذجة التأثيرات البيولوجية للعلاج الإشعاعي بالإضافة إلى ارتفاع الحرارة من حيث توزيع الجرعات المكافئة. يتيح النموذج ، الذي يفسر تثبيط إصلاح الحمض النووي عن طريق ارتفاع الحرارة ، بالإضافة إلى السمية الخلوية المستحثة بالحرارة المباشرة ، تقييم جودة خطط العلاج المركبة باستخدام الرسوم البيانية القياسية للجرعة والحجم.
للحصول على نظرة ثاقبة لتأثير معلمات ارتفاع الحرارة ، قام الفريق أولاً بحساب تعزيز التوزيع القياسي للجرعة 23 × 2 Gy بدرجات حرارة متجانسة تتراوح بين 37 و 43 درجة مئوية ، لفترات زمنية بين 0 و 4 ساعات.
أظهر النموذج أن EQDRT زاد بشكل ملحوظ مع زيادة درجة الحرارة وتقليل الفاصل الزمني. لفترة زمنية 1 ساعة ، على سبيل المثال ، توقعت EQDRT زيادة بمقدار 2-15 غراي لدرجات الحرارة من 39 إلى 43 درجة مئوية. تؤكد هذه النتائج على أهمية تحقيق أعلى درجة حرارة يمكن تحملها للورم لتحسين النتائج السريرية.
كان تأثير الفاصل الزمني أكثر وضوحا في درجات حرارة أعلى (فوق 41 درجة مئوية). عند درجة حرارة نموذجية تبلغ 41.5 درجة مئوية ، يكون EQDRT تم تحقيق زيادة تبلغ حوالي 10 Gy مع فاصل زمني 0 ساعة. انخفض هذا إلى حوالي 4 Gy مع فاصل 4 ساعات ، مما يشير إلى أنه مع زيادة الفاصل الزمني ، هناك حاجة إلى درجة حرارة أعلى لتحقيق نفس التأثير.
الحالات السريرية
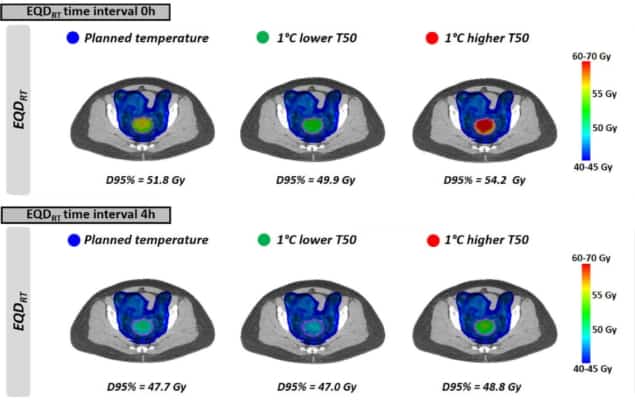
بعد ذلك ، قام الباحثون بتقييم سيناريوهات العلاج الواقعية بناءً على توزيعات درجات الحرارة غير المتجانسة وخطط العلاج الإشعاعي الإكلينيكي. قاموا بحساب EQDRT لـ 10 مرضى مصابين بسرطان عنق الرحم المتقدم محليًا. تلقى جميع المرضى 23 × 2 علاج القوس الحجمي المعدل (VMAT) ، مع تطبيق ارتفاع الحرارة أسبوعيا خلال دورة العلاج.
كما يتضح من درجات الحرارة الموحدة ، EQDRT كان الأكبر بالنسبة لأصغر فترة زمنية. عندما تم تطبيق ارتفاع الحرارة مباشرة قبل أو بعد العلاج الإشعاعي (0 ساعة فاصل زمني) ، يعني EQDRT إلى 95٪ من الحجم (D95٪) كان 51.7 غراي - بزيادة 6.3 غراي على الإشعاع وحده. أدت زيادة الفاصل الزمني إلى 4 ساعات إلى تقليل هذا الكسب إلى 2.2 غراي.
توقع النموذج أن يتم فقد معظم جرعة التحسين خلال الساعة الأولى. لذلك ، بالنسبة للاستخدام السريري ، يجب أن يكون الوقت بين العلاج الإشعاعي وعلاج ارتفاع الحرارة أقصر ما يمكن - من الناحية المثالية من قبل المرضى الذين يتلقون كلا العلاجين في نفس المستشفى. لاحظ الفريق أنه على الرغم من أن ترتيب العلاجين غير مناسب إكلينيكيًا ، حيث يستغرق الأمر وقتًا لتسخين الورم ، فإن تطبيق ارتفاع الحرارة أولاً يمكن أن يتيح فترات زمنية أقصر بكثير ، حتى قريبة من 0 ساعة.
أخيرًا ، وضع الباحثون نموذجًا لتأثير تحقيق درجات حرارة أقل للورم بشكل طفيف مما كان مخططا له ، بسبب حدوث النقاط الساخنة التي تحد من العلاج. التأثير على EQDRT كان أكثر وضوحا لفترة زمنية قصيرة بين العلاج الإشعاعي وارتفاع الحرارة. للحصول على درجة حرارة منخفضة بمقدار 1 درجة مئوية وفاصل زمني 0 ساعة ، على سبيل المثال ، المتوسط المتوقع EQDRT(D95٪) انخفض بمقدار 1.8 غراي (من 51.7 إلى 49.9 غراي) ؛ لمدة 4 ساعات ، كان الانخفاض حوالي 0.7 Gy.
العلاج الإشعاعي أكثر فاعلية في حالات الأورام التي يتم تسخينها
في الحالات التي لا تظهر فيها نقاط ساخنة ، قد يكون من الممكن زيادة طاقة الخرج والوصول إلى درجة حرارة أعلى مما هو مخطط له. مرة أخرى ، كانت فائدة تحقيق درجة حرارة أعلى هي الأكبر لفترات زمنية أقصر ، حيث يعتمد الكسب الدقيق على درجات الحرارة الفعلية التي تم الوصول إليها.
"النمذجة البيولوجية توفر نظرة ثاقبة ذات صلة بالعلاقة بين معلمات العلاج و EQD المتوقعRTواختتم كوك وزملاؤه. "كلا من درجات الحرارة المرتفعة والفترات الزمنية القصيرة ضرورية لتحقيق أقصى قدر من EQDRT.