يقول باحثون في جامعة هارفارد إن "عامل التباين الحي" يمكن أن يساعد في تشخيص إصابات الدماغ المؤلمة الخفيفة (TBI) عندما لا يُظهر التصوير بالرنين المغناطيسي التقليدي (MRI) تغيرات هيكلية. كلية الهندسة والعلوم التطبيقية.
قام الباحثون بتحميل الجادولينيوم، وهو عامل تباين قياسي في التصوير بالرنين المغناطيسي، في رقعات دقيقة تعتمد على هيدروجيل ترتبط بالخلايا المناعية، وفي الدراسات قبل السريرية تصوروا التهابًا في الخنازير المصابة بإصابات الدماغ الرضية الخفيفة. في نهاية المطاف، يتوقعون أن التكنولوجيا سوف تزيد من عدد حالات إصابات الدماغ الرضية الخفيفة التي تم تشخيصها وتحسين رعاية المرضى.
"إذا سقط شخص ما أو أصيب بصدمة خفيفة في الرأس، فقد لا يكون هناك تغيير ملحوظ في بنية الدماغ، ولكن ربما لا يزال الدماغ يعاني من ضرر كبير يمكن أن يظهر بمرور الوقت. يتم إخبار مرضى TBI المشتبه بهم أن الأمر يبدو جيدًا، فقط ليكتشفوا أن الآثار الضارة تظهر [في وقت لاحق]". سمير ميتراجوتري، الذي أجرى مختبره الدراسة. "لذلك كان هذا هو الدافع – هل يمكننا تطوير طريقة أكثر حساسية للكشف عن إصابات الدماغ الرضية الخفيفة؟" قاد تطوير التكنولوجيا ليلي لي وين وانغ، وهي طالبة دراسات عليا في مختبر ميتراجوتري. تم توفير خبرة التصوير بالرنين المغناطيسي بواسطة ريبيكا مانيكس من مستشفى بوسطن للأطفال وفريقها.
التنزه مع أكلة الجهاز المناعي المحترفة
وبما أن الجهاز المناعي يعرف أن الدماغ قد أصيب، حتى مع الصدمات "البسيطة"، فقد سعى الباحثون إلى الحصول على عامل تباين يمكن استخدامه للكشف عن الخلايا المناعية. لقد استقروا في البلاعم، وهي خلايا الدم البيضاء الوفيرة والمتنقلة، ومن بين وظائفها الأخرى في الجهاز المناعي، يتم تجنيدها في مواقع الالتهاب وابتلاع الكائنات الحية الدقيقة.
يوضح ميتراغوتري: "تشتهر البلاعم بأكل كل ما يرتبط بها، فهي آكلة محترفة". "لقد وضعنا ملصقًا على البلاعم حتى يمكن رؤية البلاعم في التصوير بالرنين المغناطيسي."
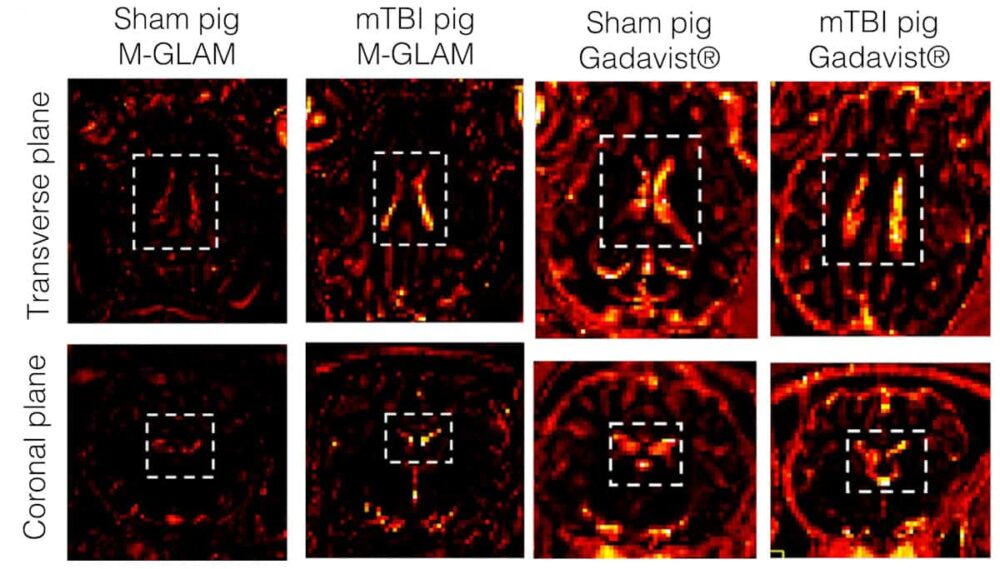
أطلق الباحثون على التكنولوجيا التي تحمل اسم Gd(III) بقعًا دقيقة متباينة الخواص، أو M-GLAMs. كما يوحي اسمها، ترتبط M-GLAMs بالبلاعم وتتصل بالدماغ المصاب. نظرًا لأن GLAMs موسومة بالجادولينيوم، يمكن للباحثين استخدام التصوير بالرنين المغناطيسي لمعرفة مكان ظهور البلاعم في الدماغ.
"ستتمركز البلاعم في أي مكان يوجد فيه الالتهاب في الدماغ، حتى تتمكن من رؤية موقع الالتهاب. لكن الهدف الأساسي هو معرفة ما إذا كان هناك التهاب أم لا. يقول ميتراجوتري: "السؤال الثانوي هو أين، لأنه في معظم الأحيان في حالة الإصابة الدماغية الرضية الخفيفة، لا تتم الإجابة على السؤال الأول".
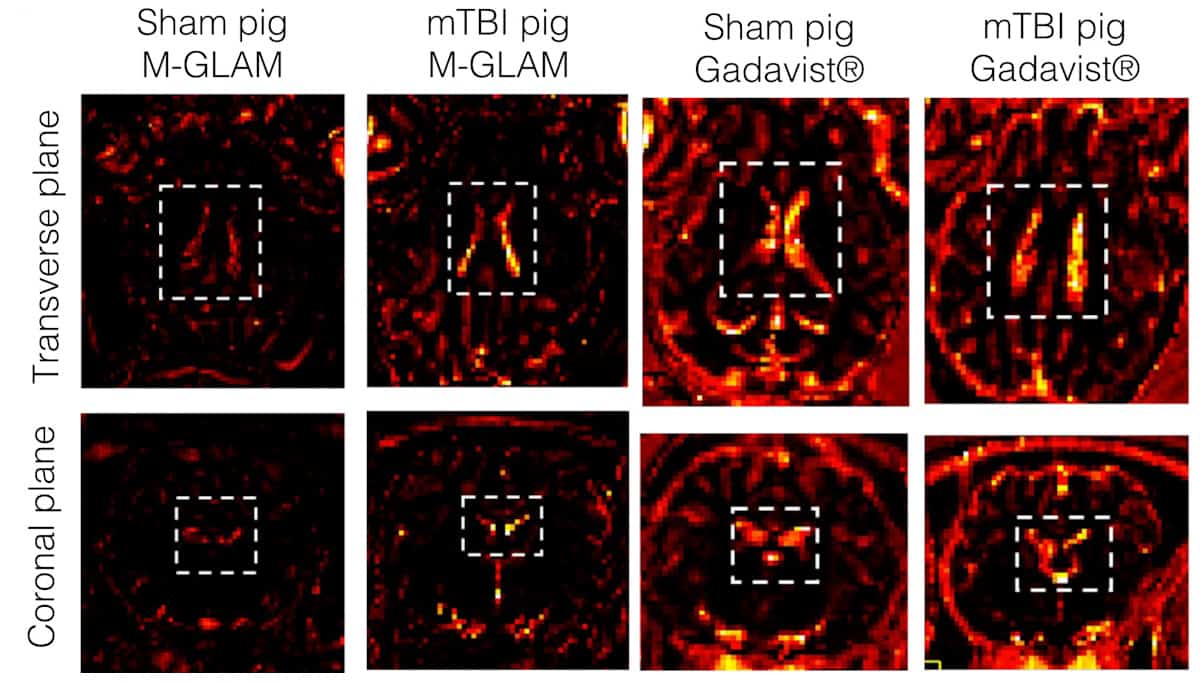
اختبر الباحثون عامل التباين عن طريق حقن GLAMs في الفئران والخنازير بجرعة واحدة أو أكثر من GLAMs لكل بلعم. على عكس Gadavist، وهو عامل تباين تجاري قائم على الجادولينيوم، لم تسبب M-GLAMs ردود فعل سلبية أو سمية واستمرت في أجسام الحيوانات لأكثر من 24 ساعة قبل أن تتم تصفيتها بواسطة الكبد والكليتين. وفي نموذج إصابة دماغ الخنازير، لاحظوا وجود M-GLAMs في الضفيرة المشيمية، وهي منطقة من الدماغ تساعد على تجنيد الخلايا المناعية من خلال حاجز السائل النخاعي الدموي. غادافيست، الذي يتخلص من الجسم بسرعة، لم يتمركز في مواقع التهاب الدماغ.
إن تركيز أيونات الجادولينيوم في GLAMs مرتفع بدرجة كافية بحيث تمكن الباحثون في الدراسات على الحيوانات من استخدام جرعة أقل من 500 إلى 1000 مرة من الجادولينيوم مقارنة بتلك الموجودة في Gadavist. ويقرون بأنه يجب اختبار M-GLAMs على عدد أكبر من الحيوانات، وأن M-GLAMs يمكن أن تنتقل إلى مواقع الالتهاب التي لا علاقة لها بالصدمة الدماغية الخفيفة.
إعداد وتوصيف GLAMs
يعمل الجادولينيوم كعامل تباين في التصوير بالرنين المغناطيسي عندما يكون هناك اتصال بالماء (تتطلب إشارات التصوير بالرنين المغناطيسي T1 تفاعلات بروتون الماء مع Gd(III)). لذا، على عكس معظم البوليمرات المستخدمة في التطبيقات الطبية الحيوية، والتي تعتبر كارهة للماء وغير مسامية، فإن GLAM مسامي ومحب للماء - وهو هيدروجيل على شكل قرص يرتبط بالبلاعم عندما تحاول البلاعم تناول حمض الهيالورونيك الموجود في الهيدروجيل.
تفشل البلاعم في هذا المسعى لأن GLAM على شكل قرص (حيث لا تستطيع البلاعم أن تأكل على شكل قرص، وقد اكتشف الباحثون جزيئات أخرى متباينة الخواص في سياق دراسة أخرى). في النهاية، ترتبط GLAMs بالبلاعم دون التأثير على هجرة البلاعم أو وظائف أخرى.
يستخدم الجهاز المحمول التحليل الطيفي للشبكية الآمن للعين لتشخيص إصابة الدماغ
يقول ميتراجوتري: "تبين أن العملية الفعلية [لتصنيع GLAMs] كانت معقدة للغاية". "لقد عمل فريقنا بجد شديد لبضع سنوات للحصول على طريقة التحضير الكاملة." يتضمن بروتوكول التصنيع الحالي خلط الجادولينيوم المعدل وحمض الهيالورونيك، وصب السائل في رقاقة بها آبار، وتدوير الرقاقة لملء القوالب بشكل موحد. يعمل ضوء الأشعة فوق البنفسجية الساطع على القوالب المغزولة على ربط سلاسل البوليمر وتشكيل GLAM صلب.
يتضمن العمل المستقبلي دراسات مفصلة عن الاستجابة الحركية والجرعة لـ M-GLAMs في الدماغ وتطوير التكنولوجيا لدى البشر، حيث تشمل التطبيقات التشخيص وربما حتى علاج حالات TBI الخفيفة والسرطانات وحالات المناعة الذاتية.
هذا البحث منشور في علوم الطب بالحركة.
- محتوى مدعوم من تحسين محركات البحث وتوزيع العلاقات العامة. تضخيم اليوم.
- PlatoData.Network Vertical Generative Ai. تمكين نفسك. الوصول هنا.
- أفلاطونايستريم. ذكاء Web3. تضخيم المعرفة. الوصول هنا.
- أفلاطون كربون، كلينتك ، الطاقة، بيئة، شمسي، إدارة المخلفات. الوصول هنا.
- أفلاطون هيلث. التكنولوجيا الحيوية وذكاء التجارب السريرية. الوصول هنا.
- المصدر https://physicsworld.com/a/macrophage-adhering-micropatches-enable-mri-to-detect-brain-inflammation/
- :لديها
- :يكون
- :ليس
- :أين
- $ UP
- 16
- 160
- 2024
- 24
- a
- ماهرون
- وفيرة
- نقر
- يقدم
- تقدم
- المعاكسة
- الوكيل
- AL
- الكل
- من بين
- an
- و
- حيوان
- الحيوانات
- آخر
- توقع
- التطبيقات
- تطبيقي
- هي
- AS
- At
- يرفق
- حاجز
- BE
- لان
- كان
- قبل
- يجري
- ربط
- الطبية الحيوية
- دم
- الهيئات
- الجسدي
- بوسطن
- دماغ
- لكن
- by
- CAN
- لا تستطيع
- يهمني
- حقيبة
- الحالات
- سبب
- خلايا
- السلاسل
- تغيير
- التغييرات
- انقر
- تجاري
- من التركيز
- الشروط
- أجرت
- التواصل
- تباين
- مراقبة
- تقليدي
- استطاع
- الدورة
- حالياًّ
- تلف
- مفصلة
- بكشف أو
- تطوير
- التطوير التجاري
- جهاز
- التشخيص
- تشخيصي
- فعل
- بجد
- اكتشف
- لا
- جرعة
- يطلق عليها اسم
- أكل
- الآثار
- تمكين
- الهندسة
- كاف
- حتى
- خبرة
- ويوضح
- بتلفيق
- فشل
- شلالات
- قليل
- شغل
- نهاية
- الاسم الأول
- مائع
- في حالة
- النموذج المرفق
- أشكال
- تبدأ من
- وظائف
- دولار فقط واحصل على خصم XNUMX% على جميع
- خريج
- هارفارد
- يملك
- رئيس
- مساعدة
- يساعد
- لها
- مرتفع
- مستشفى
- HTTPS
- البشر
- if
- ثالثا
- صورة
- التصوير
- جهاز المناعة
- التأثير
- تؤثر
- تحسن
- in
- تتضمن
- يشمل
- القيمة الاسمية
- يشير
- معلومات
- ضرر
- التفاعلات
- إلى
- المشاركة
- ينطوي
- قضية
- IT
- JPG
- كلاوي
- يعرف
- مختبر
- تُشير
- الى وقت لاحق
- ليد
- ضوء
- سائل
- كبد
- موقع
- تبدو
- خفض
- برنامج Maps
- ماكس العرض
- مايو..
- طريقة
- ربما
- الهجرة
- هجرة
- خلط
- الجوال
- نموذج
- تم التعديل
- الأكثر من ذلك
- أكثر
- التحفيز
- التصوير بالرنين المغناطيسي
- الاسم
- سيئة السمعة
- عدد
- موضوعي
- of
- on
- ONE
- فقط
- جاكيت
- or
- أخرى
- خارج
- على مدى
- المريض
- المرضى
- إلى
- فيزياء
- عالم الفيزياء
- أفلاطون
- الذكاء افلاطون البيانات
- أفلاطون داتا
- البوليمرات
- ربما
- ابتدائي
- عملية المعالجة
- محترف
- بروتوكول
- المقدمة
- نشرت
- وضع
- سؤال
- تماما
- بسرعة
- ردود الفعل
- تجنيد
- منطقة
- نسبي
- ممثل
- تطلب
- بحث
- الباحثين
- صدى
- استجابة
- Ride
- قول
- يقول
- اصابات النخاع الشوكي
- علوم
- ثانوي
- انظر تعريف
- رأيت
- حساس
- ساطع
- ينبغي
- إظهار
- إشارات
- هام
- المواقع
- So
- الصلبة
- بحث
- الطيفي
- نسج
- مربع
- معيار
- لا يزال
- الهيكلي
- بناء
- طالب
- دراسات
- دراسة
- عانى
- وتقترح
- نظام
- T1
- فريق
- تكنولوجيا
- اختبار
- من
- أن
- •
- من مشاركة
- منهم
- هناك.
- تشبه
- هم
- على الرغم من؟
- عبر
- صورة مصغرة
- الوقت
- إلى
- قال
- علاج
- صحيح
- تحول
- في النهاية
- مختلف
- تستخدم
- مستعمل
- يستخدم
- وانغ
- وكان
- مياه
- طريق..
- we
- الآبار
- كان
- أيا كان
- متى
- التي
- أبيض
- لمن
- سوف
- مع
- بدون
- للعمل
- عمل
- أعمال
- العالم
- سنوات
- أنت
- زفيرنت