Termoradioterapi er en kræftbehandling, hvor hypertermi – opvarmning af tumoren til over kropstemperatur – bruges til at øge effektiviteten af strålebehandling. Mængden af denne forbedring er udtrykt som EQDRT, den ækvivalente strålingsdosis, der er nødvendig for at opnå den samme terapeutiske effekt uden opvarmning.
Kliniske forsøg har vist, at denne tilgang væsentligt kan forbedre behandlingsresultater i flere tumortyper uden at øge normal vævstoksicitet. Tidligere undersøgelser har også vist, at både den opnåede temperatur og tidsintervallet mellem strålebehandling og hypertermi påvirker det kliniske resultat.
For at forstå denne proces mere detaljeret og hjælpe med at optimere behandlinger, har forskere på Amsterdam UMC har brugt biologisk modellering til at undersøge effekten af maksimal temperatur og tidsinterval på EQDRT. Beskriver deres resultater i International Journal of Radiation Oncology Biology Physics, rapporterer de, at både høje temperaturer og korte tidsintervaller er afgørende for at maksimere terapeutisk forbedring.
Biologisk model
For at udføre termoradioterapi bruger klinikere en radiofrekvens- eller mikrobølgeanordning til at påføre varme på tumoren en eller to gange om ugen, enten før eller efter en strålebehandlingssession. Tumortemperaturen holdes under 45°C for at forhindre opvarmning af normalt væv, men nogle gange kan der opstå uønskede (og smertefulde) varme pletter, som begrænser det maksimale tolerable effektniveau, der kan bruges under en hypertermibehandling.
Første forfatter Petra Kok og kolleger udviklede software til at modellere de biologiske virkninger af strålebehandling plus hypertermi i form af ækvivalente dosisfordelinger. Modellen, der tegner sig for DNA-reparationshæmning ved hypertermi, såvel som direkte varmeinduceret cytotoksicitet, muliggør evaluering af kvaliteten af kombinerede behandlingsplaner ved hjælp af standard dosis-volumen histogrammer.
For at opnå grundlæggende indsigt i virkningen af hypertermiparametre beregnede holdet først forbedringen af en standard 23 × 2 Gy dosisfordeling ved homogene temperaturer på mellem 37 og 43 °C, i tidsintervaller mellem 0 og 4 timer.
Modellen viste, at EQDRT steg markant med både stigende temperatur og faldende tidsinterval. For et tidsinterval på 1 time forudsagde den for eksempel en EQDRT stigning på 2–15 Gy ved temperaturer fra 39 til 43°C. Disse resultater understreger vigtigheden af at opnå den højeste tolerable tumortemperatur for at optimere det kliniske resultat.
Påvirkningen af tidsintervallet var mest udtalt ved højere temperaturer (over 41°C). Ved en typisk hypertermisk temperatur på 41.5°C er en EQDRT stigning på ca. 10 Gy blev opnået med et tidsinterval på 0 timer. Dette faldt til omkring 4 Gy-forstærkning med et 4-timers interval, hvilket indikerer, at når tidsintervallet øges, er der behov for en højere temperatur for at opnå den samme effekt.
Kliniske tilfælde
Dernæst evaluerede forskerne realistiske behandlingsscenarier baseret på inhomogene temperaturfordelinger og kliniske strålebehandlingsplaner. De beregnede EQDRT til 10 patienter med lokalt fremskreden livmoderhalskræft. Alle patienter havde modtaget 23 × 2 Gy volumetrisk-moduleret lysbueterapi (VMAT), med hypertermi påført ugentligt under behandlingsforløbet.
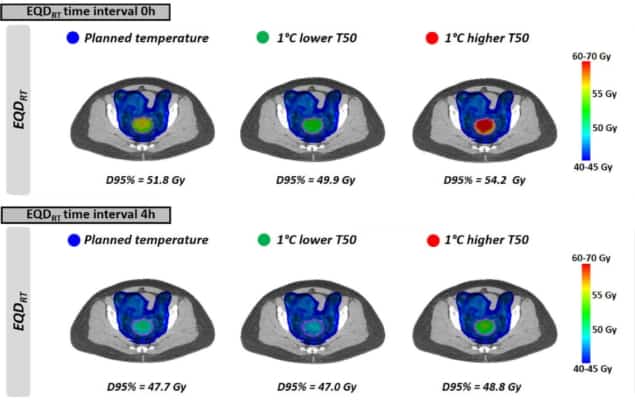
Som det ses med de ensartede temperaturer, EQDRT var størst for det mindste tidsinterval. Når hypertermi blev påført umiddelbart før eller efter strålebehandling (0 timers tidsinterval), var den gennemsnitlige EQDRT til 95 % af volumenet (D95 %) var 51.7 Gy – en gevinst på 6.3 Gy i forhold til stråling alene. Forøgelse af tidsintervallet til 4 timer reducerede denne forstærkning til 2.2 Gy.
Modellen forudsagde, at det meste af dosisforøgelsen går tabt inden for den første time. Til klinisk brug bør tiden mellem strålebehandling og levering af hypertermi derfor være så kort som muligt - ideelt set af patienter, der modtager begge behandlinger på samme hospital. Holdet bemærker, at selvom rækkefølgen af de to behandlinger ikke er klinisk relevant, da det tager tid at opvarme tumoren, kan anvendelse af hypertermi først muliggøre væsentligt kortere tidsintervaller, endda tæt på 0 timer.
Endelig modellerede forskerne virkningen af at opnå lidt lavere tumortemperaturer end planlagt på grund af forekomsten af behandlingsbegrænsende hot spots. Effekten på EQDRT var mest udtalt i et kort tidsinterval mellem strålebehandling og hypertermi. For en 1°C lavere temperatur og et tidsinterval på 0 timer, f.eks., den gennemsnitlige forudsagte EQDRT(D95%) faldt med 1.8 Gy (fra 51.7 til 49.9 Gy); i et 4 timers interval var faldet omkring 0.7 Gy.
Strålebehandling er mere effektiv ved opvarmede tumorer
I de tilfælde, hvor der ikke opstår varme punkter, kan det være muligt at øge udgangseffekten og nå en højere temperatur end planlagt. Endnu en gang var fordelen ved at opnå en højere temperatur størst for kortere tidsintervaller, med den nøjagtige forstærkning afhængig af de faktiske opnåede temperaturer.
”Biologisk modellering giver relevant indsigt i sammenhængen mellem behandlingsparametre og forventet EQDRT,” slutter Kok og kolleger. "Både høje temperaturer og korte tidsintervaller er afgørende for at maksimere EQDRT.