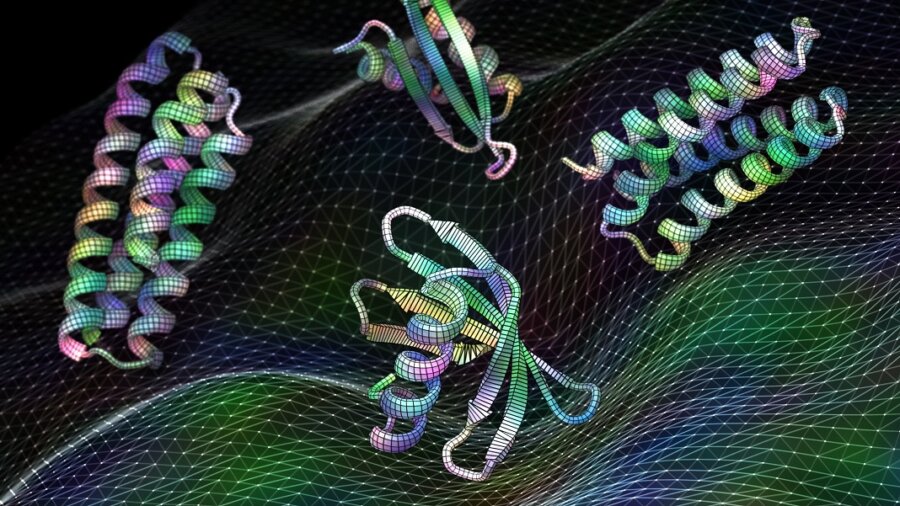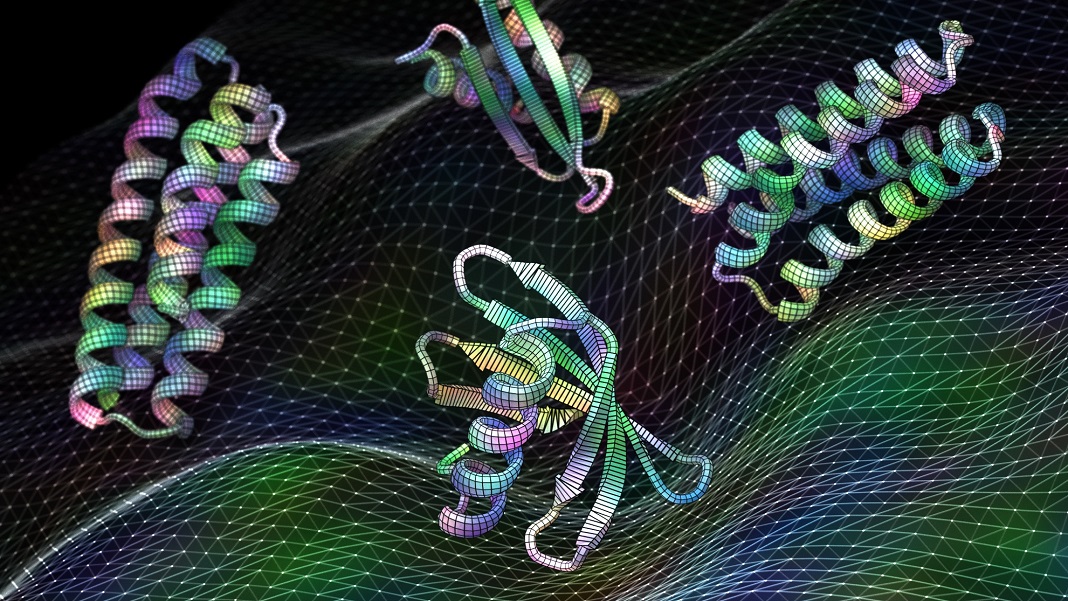
At designe et protein er lidt som at lave et skab. Det første skridt er at bygge rygraden, der holder proteinet sammen. Men så kommer den svære del: at finde ud af, hvor man skal installere hængsler på stilladset – altså finde de bedste “hotspots” – til at sætte på låger, hylder og andet tilbehør, der i sidste ende gør skabet fuldt funktionsdygtigt.
På en måde har proteiner også hotspots indlejret i deres strukturer. Tro mod deres navn, "funktionelle steder", danner disse spændende kroge og afkroge indviklede dokker, som andre proteiner eller lægemidler kan gribe fat i. Stederne er centrale for at udføre de fleste af vores grundlæggende biologiske processer. De er også en enorm guldmine til at designe nye behandlinger og medicinsk medicin.
Problemet? Funktionelle steder er svære at kortlægge. Forskere var traditionelt nødt til at mutere mistænkelige områder på et protein én efter én – skiftende en aminosyre til en anden – for at fastgøre præcise bindingspletter. Som en detektiv, der screener hundredvis af mistænkte, som der kan være mange af, er det ekstremt kedeligt.
A ny undersøgelse in Videnskab væltede hele spilbogen. Anført af Dr. David Baker ved University of Washington, tog et hold ind i en AI's "fantasi" for at opfinde et utal af funktionelle websteder fra bunden. Det er et maskinsinds "kreativitet" når det er bedst - en dyb læringsalgoritme, der forudsiger det generelle område af et proteins funktionelle sted, men derefter skulpturerer strukturen yderligere.
Som et realitetstjek brugte holdet den nye software til at generere lægemidler, der bekæmper kræft og designer vacciner mod almindelige, om end nogle gange dødelige, vira. I et tilfælde kom det digitale sind med en løsning, der, når den blev testet i isolerede celler, var et perfekt match til et eksisterende antistof mod en almindelig virus. Med andre ord "forestillede" algoritmen sig et hotspot fra et viralt protein, hvilket gør det sårbart som et mål for at designe nye behandlinger.
Algoritmen er deep learnings første forsøg på at opbygge proteiner omkring deres funktioner, hvilket åbner en dør til behandlinger, der tidligere var utænkelige. Men softwaren er ikke begrænset til naturlige protein-hotspots. "De proteiner, vi finder i naturen, er fantastiske molekyler, men designet proteiner kan så meget mere," sagde Baker i en pressemeddelelse. Algoritmen er "at gøre ting, som ingen af os troede, den ville være i stand til."
Protein Hotspot
Bakers team er ikke fremmede for at forudsige proteiner med kunstigt sind. For nogle år tilbage rystede de det strukturelle biologifelt ved at frigive Rosetta, en software, der kan forudsige et proteins 3D-struktur baseret på dets aminosyresekvens alene. De kortlagde yderligere proteinkomplekser og designede protein "skruetrækkere" fra bunden for at fjerne uønskede proteininteraktioner. I slutningen af sidste år udgav de en deep learning netværk døbt trRosetta, en AI "arkitekt", der generaliserer, hvordan strenge af aminosyrer arrangeres i indviklede strukturer på nanoskala.
Lad os bakke op.
Det er let at forestille sig proteiner som den kødfulde, senede kyllingevinge, jeg bider i, mens jeg skriver denne sætning. Men på det molekylære plan er de langt mere elegante. Forestil dig flere legoklodser - aminosyrer - holdt sammen af en snor. Snurr det nu rundt, og drej kæden, indtil nogle klodser klikker på hinanden. Dette danner en delikat struktur, der ofte ligner en helix eller krøllede sengetøj. I nogle proteiner samles disse byggesten yderligere i komplekser - for eksempel ved at skabe en kanal, der går gennem en celles beskyttende membran som en patruljeret mellemstatslig motorvej.
Proteiner driver hver eneste biologiske proces, ofte gennem en kaskade af interaktioner med andre proteiner eller lægemidler, som – afhængigt af partneren – kan udløse helt andre konsekvenser: Skal en celle leve eller dø? Angribe en potentiel angriber eller stå ned? Protein er med andre ord livets byggesten, og at analysere deres struktur er, hvordan vi kan hacke os ind i livet.
Her er sagen: Ikke alle dele af et protein er skabt lige. Hvis et protein er en menneskelig krop, er funktionelle steder dets "hænder" - hvor det griber fat i et andet protein eller lægemiddel, vækker enzymatiske reaktioner eller bekæmper invaderende patogener. Indlejret direkte i proteinets struktur er disse steder svære at fastlægge og endnu sværere at genskabe.
Den nye undersøgelse tacklede problemet med en version af Rosetta: Er det med en vis tidligere viden muligt for en computer at drømme om en kæde af aminosyrer, der naturligt foldes til et funktionelt sted?
Drømmeren og realisten
Problemet kan virke eksotisk, men der er et tidligere eksempel - på et andet område. Ved hjælp af et neuralt netværk skabte OpenAI en bred vifte af billeder fra teksttekster alene. En spinoff af rockstar AI-tekstgeneratoren GPT-3, genererede DALL·E-algoritmen fantastiske, men realistisk udseende billeder baseret på simple tekstmeddelelser ved at detektere mønstre fra dens træning. "Den tager de dybeste, mørkeste fordybninger i din fantasi og gør den til noget, der er uhyggeligt relevant," sagde Dr. Hany Farid ved UC Berkeley efter værktøjets første udgivelse.
Opbygning af et proteinfunktionelt sted er det samme. Her er aminosyrer bogstaverne, og proteinets funktionelle sted er billedet. "Idéen er den samme: neurale netværk kan trænes til at se mønstre i data. Når du er blevet trænet, kan du give den en prompt og se, om den kan generere en elegant løsning,” sagde Dr. Joseph Watson, en hovedforfatter af det nye værk. Bortset fra i stedet for at skrive en roman, kunne algoritmen hjælpe med at omskrive livet.
Holdet startede med en tidligere skabelse, trRosetta. Det er et neuralt netværk, der oprindeligt er designet til at opfinde nye proteiner baseret på aminosyresekvenser, samtidig med at det er i stand til at forudsige deres struktur - nogle så fremmede fra naturlige, at holdet kaldte deep learning's indre virkemåde "hallucination." Algoritmen virkede perfekt: den kunne både forudsige et proteins aminosyresekvens og dets struktur.
Hikken? Det virkede ikke rigtig. I modsætning, OG forudsigelse af proteinstruktur, RoseTTAFold, optrådte som en mester. Algoritmens kraft kommer fra dens design: modellering af hver aminosyre på nanoskala, hvilket giver koordinater til hvert atom. Ligesom at fastgøre et geografisk websted ved hjælp af Google Maps, giver dette et niveau af grundsandhed for en struktur, som en AI yderligere kan riffe på - en slags "begrænset hallucination."
Oversættelse? RoseTTAFold kan forudsige en funktionel struktur – specifik for det aktuelle problem – og komme med en grov skitse som det endelige design.
Så kom endnu et smart trick, kaldet "inpainting". Her gemte holdet dele af proteinsekvensen eller strukturen. Softwaren skulle lære at tyde information fra, hvad der i bund og grund er en støjende radioaflytning, hvor du kun kan høre de første par ord, men forsøge at forstå betydningen ved at udfylde de tomme felter. RoseTTAFold tacklede "problemet med gendannelse af manglende information" med velbehag og autofuldførte både aminosyresekvenser og strukturer for at konstruere en given funktionel region med høj troværdighed.
RoseTTAFold kan tackle problemerne med at opbygge aminosyresekvenser og på samme tid generere en rygrad til stedet. Det er som at sætte ord på papir: Forfatteren sørger for, at hvert bogstav er på det rigtige sted, alt imens han tjekker, at grammatikken og betydningen giver mening.
At stille spørgsmålstegn ved virkelighedens natur
Holdet satte deres nye kreation på prøve og genererede adskillige lægemiddel- og vaccinedesigns, der potentielt kunne bekæmpe vira og kræft eller hjælpe med helbredsproblemer med lavt jernindhold.
For hovedforfatteren Dr. Jue Wang blev algoritmen uventet relevant. Mens han arbejdede på projektet, blev hans to-årige søn indlagt på skadestuen på grund af en lungeinfektion af RSV (respiratorisk syncytial virus) - en virus, der normalt udviser forkølelseslignende symptomer, men som kan være dødelig hos unge og ældre.
På det tidspunkt brugte Wang algoritmen til at designe nye behandlinger, som inkluderede potentielle steder på RSV til yderligere at teste vacciner og lægemidler mod. Det er en relativt godt kortlagt struktur. Softwaren hallucinerede design, der rekapitulerede to steder, hvor vacciner potentielt kunne bindes til. Tests med hallucinerede proteiner, rekonstrueret i bakterier, fangede hurtigt eksisterende antistoffer - et tegn på, at de er funktionelle, og at den dybe læringstilgang virker.
Hændelsen "fik mig indse, at selv de 'test'-problemer, vi arbejdede på, faktisk var ret meningsfulde," sagde Wang.
I flere yderligere tests designede holdet funktionelle steder for et enzym, proteinbindende proteiner og proteiner, der griber fat i metalioner - dybest set hvordan du absorberer jern og andre vigtige metaller.
Selvom det er kraftfuldt, er der plads til vækst. Metoden åbner døren til at afmystificere naturlige proteiner, men også potentielt designe nye til syntetisk biologi. "Dette er meget kraftfulde nye tilgange, men der er stadig meget plads til forbedring," sagde Baker.
Alt i alt er det endnu en sejr for dyb læring og et medrivende udstillingsvindue for, hvordan AI og biologi kan synergi. "Deep learning transformeret proteinstruktur forudsigelse i de sidste to år, vi er nu midt i en lignende transformation af protein design," sagde Baker.
Billedkredit: Ian C. Haydon/UW Institute for Protein Design. Ny kunstig intelligens-software trænet i proteinstrukturer kan generere funktionelle proteiner, herunder disse kandidatvacciner til respiratorisk virus RSV, på få sekunder.