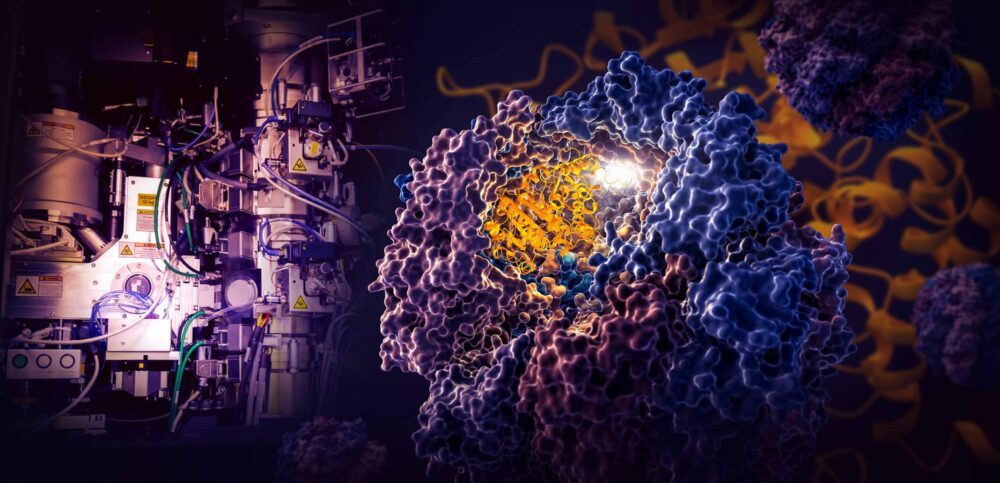
Eine bahnbrechende Studie von Forschern des SLAC National Accelerator Laboratory des US-Energieministeriums und der Stanford University zeigt, wie eine winzige Zellmaschine namens TRiC die Faltung von Tubulin steuert, einem menschlichen Protein, das den Baustein von Mikrotubuli bildet, die als Gerüst und Transportsystem der Zelle dienen .
Bisher gingen Wissenschaftler davon aus, dass TRiC und ähnliche Maschinen, sogenannte Chaperonine, passiv eine Umgebung bereitstellen, die die Faltung begünstigt, aber nicht direkt daran beteiligt sind.
Nach Schätzungen der Forscher erhalten bis zu 10 % der Proteine in unseren Zellen sowie in Pflanzen und Tieren praktische Hilfe von diesen kleinen Kammern bei der Faltung in ihre endgültige, aktive Form.
Viele der Proteine, die sich mit Hilfe von TRiC falten, stehen in engem Zusammenhang mit menschlichen Krankheiten, darunter bestimmten Krebsarten und neurodegenerativen Erkrankungen wie Parkinson, Huntington und Alzheimer, sagte Stanford-Professorin Judith Frydman, eine der Hauptautorinnen der Studie.
Tatsächlich, sagte sie, seien viele Krebsmedikamente darauf ausgelegt, Tubulin und die von ihm gebildeten Mikrotubuli zu zerstören, die für die Zellteilung wirklich wichtig sind. Daher könnte die Ausrichtung auf den TRiC-unterstützten Tubulinfaltungsprozess eine attraktive Strategie zur Krebsbekämpfung darstellen.
Das Team berichtete über die Ergebnisse seiner jahrzehntelangen Studie in einem Artikel, der in veröffentlicht wurde Zelle heute.
„Das ist die aufregendste Proteinstruktur, an der ich in meiner 40-jährigen Karriere gearbeitet habe.“ sagte SLAC/Stanford-Professor Wah Chiu, ein Pionier in der Entwicklung und Nutzung der kryogenen Elektronenmikroskopie (Kryo-EM) und Direktor der Kryo-EM- und Bioimaging-Abteilung des SLAC.
„Als ich Judith vor 20 Jahren traf“ er sagte, „Wir haben darüber gesprochen, ob wir die Faltung von Proteinen beobachten können. Das ist etwas, was die Leute seit Jahren versuchen, und jetzt haben wir es geschafft.“
Die Forscher erfassten vier verschiedene Schritte im TRiC-gesteuerten Faltungsprozess mit nahezu atomarer Auflösung mit Kryo-EM und bestätigten ihre Beobachtungen mit biochemischen und biophysikalischen Analysen.
Auf der grundlegendsten Ebene, sagte Frydman, löst diese Studie das seit langem bestehende Rätsel, warum sich Tubulin ohne die Unterstützung von TRiC nicht falten kann: „Es ist wirklich ein Wendepunkt, da es endlich eine neue Möglichkeit bietet, zu verstehen, wie sich Proteine in der menschlichen Zelle falten.“
Spaghetti zu Blumen falten
Proteine spielen bei praktisch allem, was eine Zelle tut, eine wesentliche Rolle, und herauszufinden, wie sie sich in ihren endgültigen 3D-Zustand falten, ist eine der wichtigsten Aufgaben in der Chemie und Biologie.
Wie Chiu es ausdrückt: „Ein Protein beginnt als eine Reihe von Aminosäuren, die wie Spaghetti aussehen, aber es kann erst funktionieren, wenn es zu einer Blume mit genau der richtigen Form gefaltet ist.“
Seit Mitte der 1950er Jahre wurde unser Bild davon, wie sich Proteine falten, durch Experimente geprägt, die der Forscher Christian Anfinsen vom National Institutes of Health mit kleinen Proteinen durchgeführt hat. Er entdeckte, dass ein kleines Protein, wenn er es entfaltete, spontan in die gleiche Form zurücksprang, und kam zu dem Schluss, dass die Anweisungen dafür in der Aminosäuresequenz des Proteins kodiert seien. Anfinsen erhielt 1972 den Nobelpreis Chemie für diese Entdeckung.
Dreißig Jahre später entdeckten Forscher, dass spezielle Zellmaschinen bei der Faltung von Proteinen helfen. Die vorherrschende Ansicht war jedoch, dass ihre Funktion darauf beschränkt sei, Proteinen bei der spontanen Faltung zu helfen, indem sie sie vor dem Einklemmen oder Zusammenklumpen schützt.
Eine Art von Hilfsmaschine, Chaperonin genannt, enthält eine fassartige Kammer, in der sich Proteine während ihrer Faltung befinden. TRiC passt in diese Kategorie.
Das Besondere an der TRiC-Kammer ist, dass sie aus acht verschiedenen Untereinheiten besteht, die zwei gestapelte Ringe bilden. Ein langer, dünner Strang Tubulinprotein wird von einem Helfermolekül in Form einer Qualle in die Öffnung der Kammer befördert. Dann schließt sich der Deckel der Kammer und das Falten beginnt. Wenn es fertig ist, öffnet sich der Deckel und das fertig gefaltete Tubulin kommt heraus.
Da sich Tubulin ohne TRiC nicht falten kann, schien es, dass TRiC mehr kann, als nur passiv die spontane Faltung von Tubulin zu unterstützen. Doch wie genau funktioniert das? Diese neue Studie beantwortet diese Frage und zeigt, dass das Konzept der „spontanen Faltung“ zumindest für Proteine wie Tubulin nicht gilt. Stattdessen orchestriert TRiC direkt den Faltungsweg, der zum korrekt geformten Protein führt.
Obwohl jüngste Fortschritte in der künstlichen Intelligenz (KI) die fertige, gefaltete Struktur der meisten Proteine vorhersagen können, sagt Frydman, zeige KI nicht, wie ein Protein seine richtige Form annimmt. Dieses Wissen ist von grundlegender Bedeutung für die Kontrolle der Faltung in der Zelle und die Entwicklung von Therapien für Faltungskrankheiten. Um dieses Ziel zu erreichen, müssen Forscher die detaillierten Schritte des Faltungsprozesses herausfinden, der in der Zelle abläuft.
Eine Zellkammer übernimmt die Verantwortung
Vor zehn Jahren beschlossen Frydman, Chiu und ihre Forschungsteams, tiefer in die Vorgänge in der TRIC-Kammer einzutauchen.
„Im Vergleich zu den einfacheren Faltkammern von Chaperoninen in Bakterien ist das TRiC in menschlichen Zellen eine sehr interessante und komplizierte Maschine.“ sagte Frydman. „Jede seiner acht Untereinheiten hat unterschiedliche Eigenschaften und stellt eine eigene Oberfläche innerhalb der Kammer dar, und das erweist sich als wirklich wichtig.“
Die Wissenschaftler fanden heraus, dass das Innere dieser einzigartigen Kammer den Faltvorgang auf zwei Arten steuert.

(Yanyan Zhao/Stanford University)
Wenn sich der Deckel der Kammer über einem Protein schließt, erscheinen an seinen Innenwänden Bereiche mit elektrostatischer Ladung. Sie ziehen entgegengesetzt geladene Teile des Tubulin-Proteinstrangs an und heften sie im Wesentlichen an die Wand, um die richtige Form und Konfiguration für den nächsten Schritt der Faltung zu schaffen. Währenddessen greifen die „Schwänze“ der TRiC-Untereinheit, die an der Kammerwand hängen, das Tubulin-Protein zu bestimmten Zeiten und an bestimmten Orten, um es zu verankern und zu stabilisieren.
Zunächst wird ein Ende des Tubulinstrangs in eine kleine Tasche in der Wand eingehakt und gefaltet. Dann wird das andere Ende an einer anderen Stelle befestigt, sodass eine große Schleife entsteht. Die Schlaufe lässt sich so falten, dass sie direkt neben dem ersten gefalteten Bereich liegt.
In Schritt drei faltet sich ein Teil des Mittelteils, um den Kern des Proteins zu bilden, zusammen mit Taschen, in die sich GTP, ein Molekül, das Energie speichert und freisetzt, um die Arbeit der Zelle anzutreiben, einfügen kann.
Zum Schluss wird der verbleibende Proteinabschnitt gefaltet. Das Tubulinmolekül ist nun einsatzbereit.
„Diese strukturellen Schnappschüsse von Zwischenstadien der Faltungssequenz wurden noch nie zuvor mit der Kryo-Elektronenmikroskopie gesehen.“ sagte Frydman.
Eine kraftvolle Mischung aus Techniken
Ihr Team bestätigte die Faltungssequenz mit einer anspruchsvollen Reihe biochemischer und biophysikalischer Tests, die jahrelange Arbeit erforderten.
Die Interpretation dieser Ergebnisse ermöglichte es den Forschern, ein Bild der sich verändernden Form des Tubulins zu erstellen, während es sich in der TRiC-Kammer faltet, was mit den durch Kryo-EM erzeugten Bildern übereinstimmte.
„Es ist sehr wirkungsvoll, zwischen diesen Techniken hin und her wechseln zu können, denn dann kann man wirklich wissen, dass das, was man sieht, widerspiegelt, was in der Zelle vor sich geht.“ sagte Frydman.
„Die Wissenschaft hat uns mit einer wirklich interessanten Lösung überrascht, die ich so nicht vorhergesehen hätte.“
Die Studie liefert auch Hinweise zum Verständnis, wie sich dieses Faltungssystem in eukaryotischen Zellen, aus denen Pflanzen, Tiere und Menschen bestehen, entwickelt hat, nicht jedoch in einfacheren Zellen wie denen von Bakterien und Archaeen. Da Proteine immer komplexer wurden, um den Bedürfnissen eukaryontischer Zellen gerecht zu werden, konnten sie sich nach Ansicht der Forscher irgendwann nicht mehr in die Formen falten, die sie brauchten, um kompliziertere Aufgaben ohne ein wenig Hilfe auszuführen. Eukaryotische Proteine und ihre Chaperoninkammer haben sich wahrscheinlich gemeinsam entwickelt, möglicherweise beginnend mit dem letzten gemeinsamen Vorfahren aller eukaryotischen Organismen vor etwa 2.7 Milliarden Jahren.
Aufgrund der Komplexität der Analysen und der Pandemie-Zwischenzeit dauerte die Studie so lange, dass viele der daran beteiligten Personen in andere Berufe gewechselt sind. Dazu gehören die Postdoktoranden Daniel Gestaut und Miranda Collier aus Frydmans Gruppe, die den biochemischen Teil des Projekts durchgeführt und vorangetrieben haben, sowie Yanyan Zhao, Soung-Hun Roh, Boxue Ma und Greg Pintilie aus Chius Gruppe, die die Kryo-Analyse durchführten -EM-Analysen. Weitere Mitwirkende waren Junsun Park, ein Student in Rohs Gruppe, und Alexander Leitner von der ETH in Zürich, Schweiz.
Die Arbeit wurde durch Zuschüsse des NIH an Wah Chiu und Judith Frydman sowie durch Zuschüsse der Korean National Research Foundation und der Suh Kyungbae Foundation (SUHF) an Soung-Hun Roh, der jetzt Assistenzprofessor an der Seoul National University ist, unterstützt.
Journal Referenz
- Daniel Gestaut et al., Strukturelle Visualisierung des Tubulin-Faltungswegs, der durch menschliches Chaperonin TRiC/CCT gesteuert wird. Zelle, 8. Dezember 2022 DOI: 10.1016 / j.cell.2022.11.014