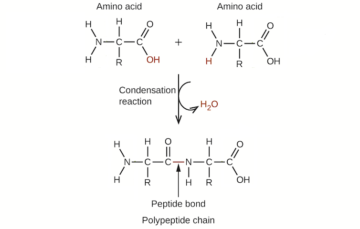
Intuition und KI bilden ein seltsames Paar.
Intuition ist schwer zu beschreiben. Es ist dieses Bauchgefühl, das an einem nagt, auch wenn man nicht weiß, warum. Wir bauen Intuition auf natürliche Weise durch Erfahrung auf. Bauchgefühle sind nicht immer richtig; Aber sie schleichen sich oft in unser Unterbewusstsein ein, um Logik und Argumentation bei der Entscheidungsfindung zu ergänzen.
Im Gegensatz dazu lernt KI schnell, indem sie Millionen kalter, harter Datenpunkte verarbeitet und auf der Grundlage ihrer Eingaben rein analytische – wenn auch nicht immer vernünftige – Ergebnisse liefert.
Jetzt, eine neue Studie in Nature Communications veröffentlicht heiratet das eine oder andere Paar, was zu einem maschinellen Lernsystem führt, das die Intuition eines Chemikers für die Arzneimittelentwicklung einfängt.
Durch die Analyse des Feedbacks von 35 Chemikern bei Novartis, einem Pharmaunternehmen mit Sitz in der Schweiz, entwickelte das Team ein KI-Modell, das von menschlichem Fachwissen in einer notorisch schwierigen Phase der Arzneimittelentwicklung lernt: der Suche nach vielversprechenden Chemikalien, die mit unserer Biologie kompatibel sind.
Zunächst nutzten die Chemiker ihre Intuition, um auszuwählen, welches der 5,000 chemischen Paare eine höhere Chance hatte, ein nützliches Medikament zu werden. Aus diesem Feedback lernte ein einfaches künstliches neuronales Netzwerk ihre Vorlieben. Bei der Herausforderung mit neuen Chemikalien vergab das KI-Modell für jede einzelne eine Bewertung, die einstufte, ob sie für die weitere Entwicklung als Medikament geeignet war.
Ohne Angaben zu den chemischen Strukturen selbst bewertete die KI „intuitiv“ bestimmte Strukturkomponenten, die häufig in bestehenden Medikamenten vorkommen, höher als andere. Überraschenderweise erfasste es auch nebulöse Eigenschaften, die in früheren Computermodellierungsversuchen nicht explizit programmiert wurden. In Kombination mit einem generativen KI-Modell wie DALL-E entwarf der Robo-Chemiker eine Reihe neuer Moleküle als potenzielle Leitmoleküle.
Viele vielversprechende Medikamentenkandidaten basierten auf „kollektivem Know-how“, schrieb das Team.
Die Studie ist eine Zusammenarbeit zwischen Novartis und Microsoft Research AI4Science, letzteres mit Sitz in Großbritannien.
Hinunter in den chemischen Kaninchenbau
Die meisten unserer Alltagsmedikamente bestehen aus kleinen Molekülen – Tylenol gegen Schmerzen, Metformin zur Behandlung von Diabetes und Antibiotika zur Bekämpfung bakterieller Infektionen.
Aber diese Moleküle zu finden ist mühsam.
Zunächst müssen Wissenschaftler verstehen, wie die Krankheit funktioniert. Sie entschlüsseln zum Beispiel die Kette biochemischer Reaktionen, die zu hämmernden Kopfschmerzen führen. Dann finden sie das schwächste Glied in der Kette, bei dem es sich häufig um ein Protein handelt, und modellieren dessen Form. Mit der Struktur in der Hand lokalisieren sie Ecken und Winkel, in denen sich Moleküle festsetzen können, um die Funktion des Proteins zu stören und so den biologischen Prozess zu stoppen – voilà, keine Kopfschmerzen mehr.
Mit unserer Proteinvorhersage-KI, wie AlphaFold, RoseTTAFold und ihre Ableger, ist es jetzt einfacher, die Struktur eines Zielproteins zu modellieren. Ein passendes Molekül zu finden, ist eine andere Sache. Das Medikament muss nicht nur die Aktivität des Ziels verändern. Es muss außerdem leicht absorbiert werden, sich auf das Zielorgan oder -gewebe ausbreiten und sicher verstoffwechselt und aus dem Körper ausgeschieden werden.
Hier kommen medizinische Chemiker ins Spiel. Diese Wissenschaftler sind Pioniere bei der Einführung der Computermodellierung. Vor über zwei Jahrzehnten begann die Branche, mithilfe von Software enorm große Datenbanken mit Chemikalien nach vielversprechenden Hinweisen zu durchsuchen. Jeder potenzielle Hinweis wird dann vor der weiteren Entwicklung von einem Team aus Chemikern bewertet.
Durch diesen Prozess entwickeln medizinische Chemiker eine Intuition dafür ermöglicht es ihnen, Entscheidungen effizient zu treffen bei der Prüfung vielversprechender Medikamentenkandidaten. Einige ihrer Schulungen können sein in Regeln destilliert damit Computer lernen können – diese Struktur wird beispielsweise wahrscheinlich nicht in das Gehirn gelangen; dass man die Leber schädigen könnte. Diese Expertenregeln haben bei der Erstprüfung geholfen. Doch bisher kann kein Programm die Feinheiten und Feinheiten ihrer Entscheidungsfindung erfassen, auch weil die Chemiker es nicht selbst erklären können.
Ich habe ein Gefühl
Ziel der neuen Studie war es, das Unerklärliche in einem KI-Modell zu erfassen.
Das Team rekrutierte 35 erfahrene Chemiker in verschiedenen Novartis-Zentren auf der ganzen Welt, jeder mit unterschiedlichem Fachwissen. Einige arbeiten beispielsweise mit Zellen und Geweben, andere mit Computermodellen.
Intuition ist schwer zu messen. Es ist auch nicht gerade zuverlässig. Als Grundlage entwickelte das Team ein Multiplayer-Spiel, um zu beurteilen, ob jeder Chemiker in seinen Entscheidungen konsistent war und ob seine Entscheidungen mit denen der anderen übereinstimmten. Jedem Chemiker wurden 220 Molekülpaare gezeigt und ihm wurde eine absichtlich vage Frage gestellt. Stellen Sie sich zum Beispiel vor, Sie nehmen an einer ersten virtuellen Screening-Kampagne teil und wir benötigen ein Medikament, das als Pille eingenommen werden kann – welches Molekül würden Sie bevorzugen?
Das Ziel bestand darin, übermäßiges Nachdenken zu reduzieren und die Chemiker dazu zu bringen, sich auf ihre Intuition zu verlassen, um herauszufinden, welche Chemikalie bleibt und welche verschwindet. Dieser Aufbau unterscheidet sich von üblichen Auswertungen, bei denen die Chemiker bestimmte molekulare Eigenschaften mit Vorhersagemodellen – also harten Daten – abhaken.
Die Chemiker waren in ihrer eigenen Einschätzung konsistent, waren sich jedoch nicht immer einig – wahrscheinlich aufgrund unterschiedlicher persönlicher Erfahrungen. Es gebe jedoch genügend Überschneidungen, um ein zugrunde liegendes Muster zu bilden, aus dem ein KI-Modell lernen könne, erklärte das Team.
Als nächstes bauten sie den Datensatz auf 5,000 Molekülpaare auf. Die Moleküle, die jeweils mit Informationen zu ihrer Struktur und anderen Merkmalen beschriftet waren, wurden zum Trainieren eines einfachen künstlichen neuronalen Netzwerks verwendet. Mit dem Training passte das KI-Netzwerk sein Innenleben basierend auf dem Feedback der Chemiker weiter an und vergab schließlich für jedes Molekül eine Punktzahl.
Zur Überprüfung der Plausibilität testete das Team das Modell anhand von chemischen Paaren, die sich von denen in seinem Trainingsdatensatz unterschieden. Als sie die Anzahl der Trainingsbeispiele erhöhten, stieg die Leistung sprunghaft an.
Während sich frühere Computerprogramme auf Regeln dafür stützten, was ein vielversprechendes Medikament auf der Grundlage der Molekülstruktur ausmacht, spiegelten die Ergebnisse des neuen Modells keine dieser Regeln direkt wider. Die KI erfasste eine ganzheitlichere Sicht auf eine Chemikalie – ein völlig anderer Ansatz Wirkstoffforschung als die, die in klassischer Robo-Chemiker-Software verwendet wird.
Mithilfe der KI überprüfte das Team dann Hunderte von von der FDA zugelassenen Arzneimitteln und Tausende von Molekülen aus einer Chemikaliendatenbank. Auch ohne explizites Training extrahierte das Modell chemische Strukturen – sogenannte „Fragmente“ –, die sich besser für die weitere Entwicklung als Arzneimittel eignen. Die Bewertungspräferenzen der KI stimmten mit denen bestehender drogenähnlicher Moleküle überein, was darauf hindeutet, dass sie den Kern dessen erfasst hatte, was einen potenziellen Hinweis ausmacht.
Chemische Romanze
Novartis ist nicht das erste Unternehmen, das eine chemische Romanze zwischen Mensch und Roboter erforscht.
Zuvor der Pharmakonzern Merck auch angetippt nutzen ihr internes Fachwissen, um Chemikalien nach einer wünschenswerten Eigenschaft einzustufen. Außerhalb der Branche, ein Team an der Universität Glasgow erforschte den Einsatz intuitionsbasierter Roboter für anorganische chemische Experimente.
Es handelt sich immer noch um eine kleine Studie, und die Autoren können menschliche Irrtümer nicht ausschließen. Einige Chemiker entscheiden sich möglicherweise aufgrund persönlicher Vorurteile für ein Molekül, die sich nur schwer vollständig vermeiden lassen. Der Aufbau könnte jedoch zur Untersuchung anderer Schritte in der Arzneimittelentwicklung genutzt werden, deren experimentelle Durchführung kostspielig ist. Und obwohl das Modell auf Intuition basiert, könnten seine Ergebnisse durch regelbasierte Filter unterstützt werden, um seine Leistung weiter zu verbessern.
„Wir befinden uns in einer Ära, in der maschinelles Lernen Zehntausende von Molekülen entwerfen kann“, erklärte das Team. Ein mit Intuition ausgestatteter Assistenz-KI-Chemiker könnte dabei helfen, Kandidaten in der entscheidenden frühen Phase der Arzneimittelentwicklung einzugrenzen und so den gesamten Prozess zu beschleunigen.
Bild-Kredit: Eugenia Kozyr / Unsplash
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoData.Network Vertikale generative KI. Motiviere dich selbst. Hier zugreifen.
- PlatoAiStream. Web3-Intelligenz. Wissen verstärkt. Hier zugreifen.
- PlatoESG. Kohlenstoff, CleanTech, Energie, Umwelt, Solar, Abfallwirtschaft. Hier zugreifen.
- PlatoHealth. Informationen zu Biotechnologie und klinischen Studien. Hier zugreifen.
- Quelle: https://singularityhub.com/2023/11/03/how-to-give-ai-a-gut-feeling-for-which-molecules-will-make-the-best-drugs/
- :Ist
- :nicht
- :Wo
- $UP
- 000
- 220
- 35%
- a
- beschleunigen
- Aktivität
- Bereinigt
- Adoption
- vor
- Übereinstimmung
- AI
- ebenfalls
- immer
- an
- Analyse
- und
- Ein anderer
- jedem
- Ansatz
- SIND
- bewaffnet
- um
- künstlich
- AS
- Assistentin
- At
- Versuche
- Autoren
- vermeiden
- basierend
- Baseline
- BE
- weil
- Werden
- Bevor
- begann
- BESTE
- zwischen
- Vorurteile
- Biologie
- Körper
- Gehirn
- bauen
- erbaut
- aber
- by
- Kampagnen (Campaign)
- CAN
- Kandidaten
- Erfassung
- gefangen
- Captures
- Die Zellen
- Centers
- sicher
- Kette
- herausgefordert
- Chance
- aus der Ferne überprüfen
- chemisch
- Entscheidungen
- Auswählen
- klassisch
- Kälte
- Zusammenarbeit
- wie die
- Unternehmen
- kompatibel
- abschließen
- uneingeschränkt
- Komponenten
- Computer
- Computer
- konsistent
- Kontrast
- könnte
- Paar
- Kredit
- kritischem
- Dalls
- Organschäden
- technische Daten
- Datenpunkte
- Datenbanken
- Jahrzehnte
- Entziffern
- Decision Making
- Entscheidungen
- beschreiben
- Design
- entworfen
- Details
- entwickelt
- Entwicklung
- Diabetes
- anders
- verschieden
- schwer
- Direkt
- Entdeckung
- Krankheit
- Störung
- Tut nicht
- Nicht
- nach unten
- Medikament
- Drogen
- jeder
- Früher
- Früh
- Startup-Gründer
- einfacher
- leicht
- eliminiert
- enorm
- genug
- Era
- Bewerten
- Auswertungen
- Sogar
- schließlich
- jeden Tag
- genau
- Beispiel
- vorhandenen
- teuer
- ERFAHRUNGEN
- Erfahrungen
- Experimente
- Experte
- Expertise
- Erklären
- erklärt
- explizit
- ERKUNDEN
- Erkundet
- weit
- Eigenschaften
- Feedback
- Gefühle
- Feld
- Kampf
- Filter
- Finden Sie
- Suche nach
- Vorname
- Aussichten für
- unten stehende Formular
- für
- Funktion
- weiter
- weitere Entwicklung
- Spiel
- Spur
- gab
- generativ
- Generative KI
- ABSICHT
- Unterstützung
- Kundenziele
- Goes
- habe
- hätten
- Pflege
- hart
- Haben
- Kopfschmerzen
- Hilfe
- dazu beigetragen,
- höher
- ganzheitliche
- Ultraschall
- Hilfe
- aber
- HTTPS
- human
- hunderte
- if
- Bild
- zu unterstützen,
- in
- hat
- Energiegewinnung
- Infektionen
- Information
- Anfangs-
- Varianten des Eingangssignals:
- Instanz
- absichtlich
- in
- Feinheiten
- IT
- SEINE
- nur
- Wissen
- grosse
- führen
- umwandeln
- LERNEN
- gelernt
- lernen
- Gefällt mir
- wahrscheinlich
- LINK
- Leber
- Logik
- suchen
- Maschine
- Maschinelles Lernen
- gemacht
- um
- MACHT
- Making
- Management
- abgestimmt
- Materie
- messen
- Medikation
- Medikamente
- Medizin
- Metformin
- Microsoft
- könnte
- Millionen
- Modell
- Modellieren
- Molekular-
- Molekül
- mehr
- Multiplayer
- sollen
- schmal
- Natur
- Need
- Netzwerk
- Nerven-
- neuronale Netzwerk
- Neu
- weiter
- NIH
- nicht
- Novartis
- jetzt an
- Anzahl
- of
- WOW!
- vorgenommen,
- on
- EINEM
- or
- Andere
- Anders
- UNSERE
- aussen
- übrig
- besitzen
- Schmerzen
- Paar
- gepaart
- Paare
- passieren
- Schnittmuster
- Leistung
- persönliche
- Biowissenschaften
- Picks
- Pioniere
- Plato
- Datenintelligenz von Plato
- PlatoData
- Punkte
- Potenzial
- Prognose
- bevorzugen
- Vorlieben
- früher
- Prozessdefinierung
- Herstellung
- Programm
- programmierten
- Programme
- aussichtsreich
- immobilien
- Proteine
- rein
- Schieben
- Putting
- Frage
- Hase
- Rang
- Platz
- schnell
- Reaktionen
- Veteran
- reflektieren
- zuverlässig
- verlassen
- Forschungsprojekte
- was zu
- Die Ergebnisse
- Überprüfung
- Recht
- Roboter
- Romantik
- Regel
- Ohne eine erfahrene Medienplanung zur Festlegung von Regeln und Strategien beschleunigt der programmatische Medieneinkauf einfach die Rate der verschwenderischen Ausgaben.
- sicher
- Wissenschaftler
- Ergebnis
- Wertung
- regelmäßigen Abständen
- Setup
- Form
- Schuss
- gezeigt
- Sieben
- Einfacher
- klein
- So
- bis jetzt
- Software
- einige
- gesucht
- spezifisch
- Verbreitung
- Stufe
- Shritte
- Immer noch
- Stoppen
- seltsam
- strukturell
- Struktur
- Strukturen
- Studie
- so
- ergänzen
- Schweiz
- System
- gemacht
- Target
- Team
- Zehn
- getestet
- als
- zur Verbesserung der Gesundheitsgerechtigkeit
- Das
- Großbritannien
- die Welt
- ihr
- Sie
- sich
- dann
- Dort.
- damit
- Diese
- vom Nutzer definierten
- fehlen uns die Worte.
- diejenigen
- Tausende
- Durch
- zu
- TOTAL
- Training
- Ausbildung
- WENDE
- XNUMX
- Uk
- zugrunde liegen,
- verstehen
- Universität
- benutzt
- Verwendung von
- üblich
- verschiedene
- Anzeigen
- Assistent
- wurde
- we
- waren
- Was
- wann
- ob
- welche
- während
- ganze
- warum
- werden wir
- mit
- ohne
- Arbeiten
- Arbeiten
- Werk
- weltweit wie ausgehandelt und gekauft ausgeführt wird.
- würde
- schrieb
- Du
- Zephyrnet