Die Thermoradiotherapie ist eine Krebsbehandlung, bei der Hyperthermie – das Erhitzen des Tumors auf über Körpertemperatur – verwendet wird, um die Wirksamkeit der Strahlentherapie zu verbessern. Der Betrag dieser Verbesserung wird als EQD ausgedrücktRT, die äquivalente Strahlendosis, die benötigt wird, um die gleiche therapeutische Wirkung ohne Erwärmung zu erzielen.
Klinische Studien haben gezeigt, dass dieser Ansatz die Behandlungsergebnisse bei mehreren Tumorarten erheblich verbessern kann, ohne die Toxizität des normalen Gewebes zu erhöhen. Frühere Studien zeigten auch, dass sowohl die erreichte Temperatur als auch das Zeitintervall zwischen Strahlentherapie und Hyperthermie das klinische Ergebnis beeinflussen.
Um diesen Prozess genauer zu verstehen und zur Optimierung von Behandlungen beizutragen, forschen Forscher an Amsterdam UMC haben biologische Modelle verwendet, um die Auswirkungen der maximalen Temperatur und des Zeitintervalls auf EQD zu untersuchenRT. Beschreibung ihrer Ergebnisse in der International Journal of Radiooncology Biology Physicsberichten sie, dass sowohl hohe Temperaturen als auch kurze Zeitintervalle wesentlich sind, um die therapeutische Verbesserung zu maximieren.
Biologisches Modell
Zur Durchführung der Thermoradiotherapie verwenden Ärzte ein Hochfrequenz- oder Mikrowellengerät, um dem Tumor ein- oder zweimal pro Woche Wärme zuzuführen, entweder vor oder nach einer Strahlentherapiesitzung. Die Tumortemperatur wird unter 45 °C gehalten, um eine Erwärmung des normalen Gewebes zu verhindern, aber manchmal können unerwünschte (und schmerzhafte) Hotspots auftreten, die den maximal tolerierbaren Leistungspegel begrenzen, der während einer Hyperthermiebehandlung verwendet werden kann.
Erster Autor Petra Kök und Kollegen entwickelten eine Software zur Modellierung der biologischen Wirkungen von Strahlentherapie plus Hyperthermie in Form von Äquivalentdosisverteilungen. Das Modell, das die Hemmung der DNA-Reparatur durch Hyperthermie sowie die durch direkte Hitze induzierte Zytotoxizität berücksichtigt, ermöglicht die Bewertung der Qualität kombinierter Behandlungspläne unter Verwendung von Standard-Dosis-Volumen-Histogrammen.
Um einen grundlegenden Einblick in die Auswirkungen von Hyperthermieparametern zu erhalten, berechnete das Team zunächst die Verbesserung einer Standarddosisverteilung von 23 × 2 Gy durch homogene Temperaturen zwischen 37 und 43 °C für Zeitintervalle zwischen 0 und 4 h.
Das Modell zeigte, dass EQDRT nahm sowohl mit zunehmender Temperatur als auch mit abnehmendem Zeitintervall signifikant zu. Für ein Zeitintervall von 1 h wurde beispielsweise ein EQD vorhergesagtRT Erhöhung um 2–15 Gy bei Temperaturen von 39 bis 43°C. Diese Ergebnisse unterstreichen die Bedeutung des Erreichens der höchsten tolerierbaren Tumortemperatur, um das klinische Ergebnis zu optimieren.
Der Einfluss des Zeitintervalls war am ausgeprägtesten bei höheren Temperaturen (über 41 °C). Bei einer typischen hyperthermischen Temperatur von 41.5 °C ist ein EQDRT Bei einem Zeitintervall von 10 h wurde ein Anstieg von etwa 0 Gy erreicht. Dies verringerte sich auf etwa 4 Gy Verstärkung mit einem 4-Stunden-Intervall, was darauf hinweist, dass mit zunehmendem Zeitintervall eine höhere Temperatur erforderlich ist, um den gleichen Effekt zu erzielen.
Klinische Fälle
Als nächstes bewerteten die Forscher realistische Behandlungsszenarien basierend auf inhomogenen Temperaturverteilungen und klinischen Bestrahlungsplänen. Sie berechneten den EQDRT für 10 Patientinnen mit lokal fortgeschrittenem Gebärmutterhalskrebs. Alle Patienten hatten eine 23 × 2 Gy volumetrisch modulierte Lichtbogentherapie (VMAT) erhalten, wobei während des Behandlungsverlaufs wöchentlich Hyperthermie angewendet wurde.
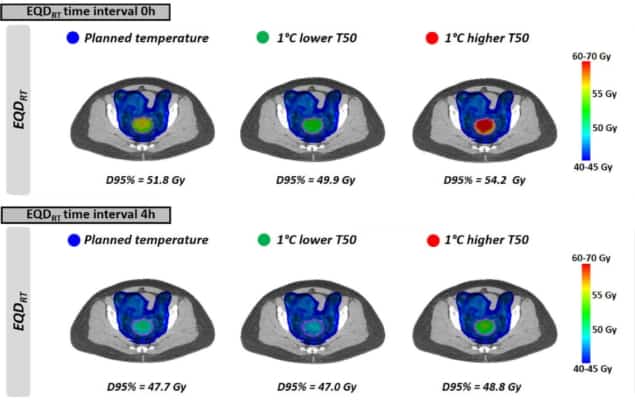
Wie bei den gleichmäßigen Temperaturen zu sehen ist, EQDRT war für das kleinste Zeitintervall am größten. Wenn die Hyperthermie unmittelbar vor oder nach der Strahlentherapie (Zeitintervall 0 h) angewendet wurde, war der mittlere EQDRT zu 95 % des Volumens (D95 %) betrug 51.7 Gy – ein Gewinn von 6.3 Gy gegenüber der alleinigen Bestrahlung. Eine Erhöhung des Zeitintervalls auf 4 h reduzierte diesen Gewinn auf 2.2 Gy.
Das Modell sagte voraus, dass der größte Teil der Dosissteigerung innerhalb der ersten Stunde verloren geht. Für den klinischen Einsatz sollte daher die Zeit zwischen Strahlentherapie und Hyperthermieabgabe so kurz wie möglich sein – idealerweise bei Patienten, die beide Behandlungen im selben Krankenhaus erhalten. Das Team stellt fest, dass die Reihenfolge der beiden Behandlungen zwar klinisch nicht relevant ist, da das Aufheizen des Tumors einige Zeit in Anspruch nimmt, die Anwendung der Hyperthermie jedoch zunächst deutlich kürzere Zeitintervalle ermöglichen könnte, sogar nahe 0 h.
Schließlich modellierten die Forscher die Auswirkungen des Erreichens etwas niedrigerer Tumortemperaturen als geplant aufgrund des Auftretens von behandlungsbegrenzenden Hot Spots. Die Wirkung auf EQDRT war am ausgeprägtesten für ein kurzes Zeitintervall zwischen Strahlentherapie und Hyperthermie. Für eine um 1 °C niedrigere Temperatur und ein Zeitintervall von 0 h beispielsweise der mittlere vorhergesagte EQDRT(D95%) sank um 1.8 Gy (von 51.7 auf 49.9 Gy); für ein 4-Stunden-Intervall betrug die Abnahme etwa 0.7 Gy.
Die Strahlentherapie ist bei aufgewärmten Tumoren wirksamer
In Fällen, in denen keine Hot Spots auftreten, kann es möglich sein, die Ausgangsleistung zu erhöhen und eine höhere Temperatur als geplant zu erreichen. Auch hier war der Vorteil des Erreichens einer höheren Temperatur für kürzere Zeitintervalle am größten, wobei der genaue Gewinn von den tatsächlich erreichten Temperaturen abhängt.
„Biologische Modellierung liefert relevante Einblicke in die Beziehung zwischen Behandlungsparametern und erwartetem EQDRT“, schließen Kok und seine Kollegen. „Sowohl hohe Temperaturen als auch kurze Zeitintervalle sind unerlässlich, um EQD zu maximierenRT.