Ρικ Γιανγκ είναι καθηγητής βιολογίας στο MIT που μελετά το RNA που μεταγράφεται από το τμήμα του γονιδιώματος που δεν κωδικοποιεί πρωτεΐνες, γνωστό ως μη κωδικοποιητικό DNA. Αυτό το τμήμα του γονιδιώματος κάποτε αναφερόταν ως «άχρηστο DNA», το οποίο σας δίνει μια αίσθηση του τι νόμιζαν πολλοί για την αξία του. Οι επιστήμονες τρόμαξαν όταν ανακάλυψαν ότι αποτελεί το 98% του ανθρώπινου γονιδιώματος, γεγονός που πυροδότησε μια αναζήτηση για την εύρεση των λειτουργιών του.
Σε αυτή τη συνομιλία, ο Rick Young συνομιλεί με τον Χάνε Βινάρσκι από την Bio Eats World και τον γενικό συνεργάτη της a16z Χόρχε Κόντε, ο οποίος ηγείται των επενδύσεων στη διασταύρωση της βιολογίας, της επιστήμης των υπολογιστών και της μηχανικής. Πριν ενταχθεί στην a16z, ο Conde ήταν Chief Strategy Officer στη Syros Pharmaceuticals και συνιδρυτής της εταιρείας ερμηνείας γονιδιωματικών Knome.
Η συζήτηση καλύπτει όσα μάθαμε για το 98% του γονιδιώματος που πιστεύαμε ότι ήταν σκουπίδια. Αποδεικνύεται ότι έχει διάφορες δουλειές που κυμαίνονται από την απόκρυψη των στοιχείων των αρχαίων ιογενών λοιμώξεων έως το να κάνει κάθε πρόσωπο να φαίνεται μοναδικό. Συζητούν επίσης τον τεράστιο αλλά ακόμα ελάχιστα κατανοητό ρόλο του στην ασθένεια και πώς η μελέτη του ανεπιθύμητου DNA οδήγησε στην ανακάλυψη ενός διακόπτη ενεργοποίησης/απενεργοποίησης γονιδίου που κανείς δεν περίμενε.
Σημείωση: αυτή η συνομιλία δημοσιεύτηκε αρχικά ως επεισόδιο του Το Bio Eats World. Μπορείτε να ακούσετε αυτό το επεισόδιο εδώ.
HANNE WINARSKY: Είμαστε εδώ για να μιλήσουμε σήμερα για αυτό που ονομάζεται junk DNA. Μπορούμε να ξεκινήσουμε με έναν απλό ορισμό;
RICK YOUNG: Αυτός είναι ένας όρος περίπου μισού αιώνα. Οι επιστήμονες γνώριζαν για τμήματα του γονιδιώματος που δεν κωδικοποιούν πρωτεΐνες, και αυτοί θεωρητικά ότι αυτό ήταν σκουπίδια. Γνωρίζαμε ότι μερικά από αυτά ήταν απλώς τα απομεινάρια αρχαίων ιικών εισβολών στο γονιδίωμα. Αλλά αυτή η φράση, το παλιό DNA, μας έχει στοιχειώσει.
HANNE: Ποιος είναι λοιπόν ο όρος που προσπαθείτε να χρησιμοποιήσετε; Η σκοτεινή ύλη του DNA για την οποία καταλαβαίνουμε περισσότερο κάθε μέρα;
RICK: Μη κωδικοποιητικό DNA.
ΧΑΝΝΕ: Γιατί το σκέφτηκαν ως απορρίμματα; Αναφέρατε μερικά από αυτά ήταν υπολείμματα παλαιών κομματιών ιών. Γιατί όμως δεν ήταν απλώς ένα μυστήριο από την αρχή;
RICK: Επειδή σε όλη τη βιολογική ιστορία, υπήρχε αυτή η συζήτηση για το ποιο ήταν το γενετικό υλικό και αρχικά θεωρήθηκε ότι ήταν πρωτεΐνη. Αλλά μόλις έγινε σαφές ότι η πρωτεΐνη ήταν το μηχάνημα και το DNA ήταν το σχέδιο για τον μηχανισμό, οι άνθρωποι ασχολήθηκαν με το μηχάνημα επειδή τα ελαττώματα του μηχανήματος προκαλούν ασθένειες. Στη συνέχεια όμως αποδείχθηκε ότι μόνο το 2% του γονιδιώματος κωδικοποιεί τα αμινοξέα για τις πρωτεΐνες. Η συντριπτική πλειοψηφία, το 98%, όχι. Και το 2000, όταν οι επιστήμονες του Human Genome Project παρουσιάζονται την αλληλουχία του ανθρώπινου γονιδιώματος, αυτά τα δεδομένα επιβεβαίωσαν ότι το 98% των 3.2 δισεκατομμυρίων βάσεων μας δεν κωδικοποιούν πρωτεΐνες.
Κάθε γονίδιο έχει αυτή την αξιοσημείωτη ικανότητα να παίρνει κομμάτια και κομμάτια τμημάτων της πρωτεΐνης που θα κωδικοποιήσει και να τα τακτοποιήσει έτσι ώστε το προϊόν που λαμβάνετε σε ένα κύτταρο μπορεί να λειτουργεί λίγο πιο γρήγορα ή σε ένα άλλο κύτταρο μπορεί πραγματικά να πάει σε διαφορετικό διαμέρισμα για να κάνετε μια διαφορετική δουλειά.
ΧΟΡΧΕ ΚΟΝΤΕ: Ποιες ήταν οι αρχικές εκτιμήσεις για το πόσα γονίδια θα κωδικοποιούνταν σε αυτά τα 3.2 δισεκατομμύρια ζεύγη βάσεων;
RICK: Συμπληρώσαμε περίπου 100,000. Απλώς υποθέσαμε ότι όσο πιο πολύπλοκοι είμαστε, τόσο μεγαλύτερο είναι το γονιδίωμα και τόσο μεγαλύτερος ο αριθμός των γονιδίων. Υπήρξε λίγο σοκ όταν συνειδητοποιήσαμε ότι εμείς και τα έντομα έχουμε περίπου τον ίδιο αριθμό γονιδίων.
ΧΟΡΧΕ: Λιγότερα γονίδια από όσα περιμέναμε να κωδικοποιήσουν έναν οργανισμό που θεωρούμε ότι είναι απίστευτα πολύπλοκος, σωστά;
HANNE: Αυτό είναι λίγο σοκ.
Ίδιος πηγαίος κώδικας, διαφορετικά προγράμματα
ΧΟΡΧΕ: Κάτι που όλοι μάθαμε στο γυμνάσιο είναι ότι το DNA κωδικοποιεί το RNA, το RNA κωδικοποιεί τα αμινοξέα και τα αμινοξέα μας δίνουν πρωτεΐνες, σωστά; Αυτό είναι το κεντρικό δόγμα της σύγχρονης βιολογίας.
RICK: Ναι. Ένας από τους μεγάλους λόγους για τους οποίους οι άνθρωποι έσπευσαν να αποδώσουν τον τίτλο «άχρηστο DNA» σε εκείνο το 98% του γονιδιώματος που δεν κωδικοποιεί τις πρωτεΐνες είναι επειδή πιστεύεται, σε μεγάλο βαθμό, ότι το επιχειρηματικό τέλος του γονιδιώματος ήταν να κάνει πρωτεΐνες.
ΧΟΡΧΕ: Πότε λοιπόν οι γενετιστές άρχισαν να νιώθουν ότι το ανεπιθύμητο DNA μπορεί να είναι κάτι περισσότερο από σκουπίδια;
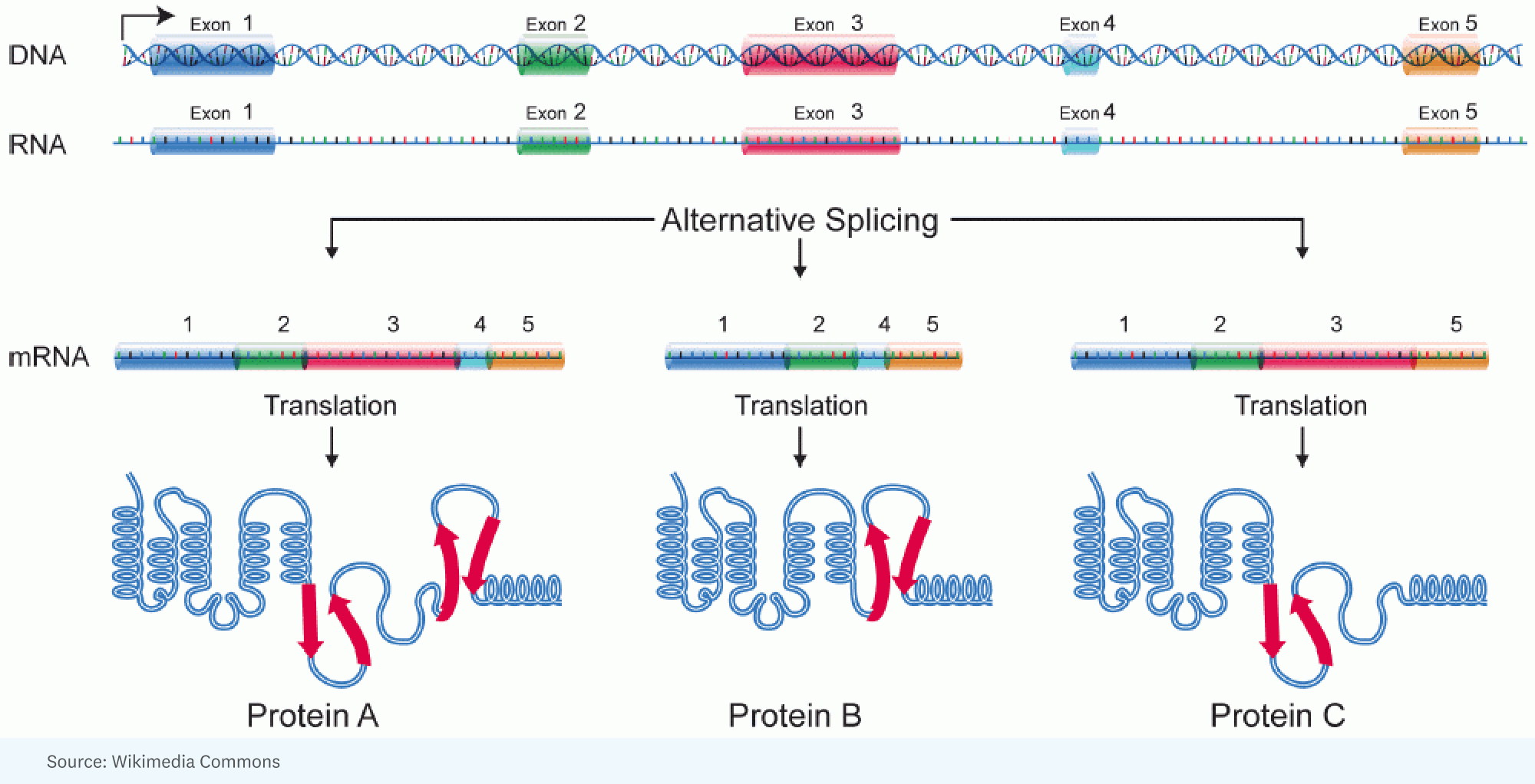
RICK: [Ξεκίνησε με] τη συνειδητοποίηση ότι θα μπορούσατε να εξηγήσετε την πρόσθετη πολυπλοκότητα στους ανθρώπους έναντι των εντόμων με μια τεράστια ποσότητα εναλλακτικών ματιών. Εκεί έχετε, για ένα μόνο γονίδιο, ένα μεγάλο RNA που δημιουργείται, αλλά ματίζεται διαφορετικά σε ένα κύτταρο έναντι ενός άλλου κυττάρου. Με άλλα λόγια, διαφορετικά τμήματα του γονιδίου καταλήγουν στο μόριο RNA που πρόκειται να καθορίσει την πρωτεΐνη. Άρα η πρωτεΐνη είναι λίγο διαφορετική.
HANNE: Αυτό ακούγεται σαν καλειδοσκόπιο λίγο με το φως να το χτυπά διαφορετικά, έχετε διαφορετικά χρώματα, διαφορετικές γωνίες.
RICK: Λοιπόν, και αυτή είναι μια ενδιαφέρουσα αναλογία. Νομίζω ότι μια καλύτερη αναλογία είναι όταν έχεις αυτά τα Lego, και μπορείς να φτιάξεις μια μηχανή, αλλά μπορείς να την φτιάξεις με τόσους διαφορετικούς τρόπους, τόσες πολλές διαφορετικές δομές, χρώματα. Κάθε γονίδιο έχει αυτή την αξιοσημείωτη ικανότητα να παίρνει κομμάτια και κομμάτια τμημάτων της πρωτεΐνης που θα κωδικοποιήσει και να τα τακτοποιήσει έτσι ώστε το προϊόν που λαμβάνετε σε ένα κύτταρο μπορεί να λειτουργεί λίγο πιο γρήγορα ή σε ένα άλλο κύτταρο μπορεί πραγματικά να πάει σε διαφορετικό διαμέρισμα για να κάνετε μια διαφορετική δουλειά.
ΧΟΡΧΕ: Κάθε κύτταρο σε έναν δεδομένο άνθρωπο έχει περίπου το ίδιο γονιδίωμα. Ωστόσο, το ίδιο γονιδίωμα δημιουργεί μια απίστευτα ποικιλόμορφη σειρά διαφορετικών τύπων κυττάρων. Και έτσι, στο βαθμό που θα κάνουμε μια αναλογία, κάθε τύπος κελιού εκτελεί ένα διαφορετικό πρόγραμμα από τον ίδιο πηγαίο κώδικα.
RICK: Έτσι είναι.
Οι λειτουργίες του 98%
ΧΟΡΧΕ: Δεν χρειάζεται να είσαι ειδικός για να εξετάσεις διαφορετικούς τύπους κυττάρων και να δεις πόσο ποικίλοι μπορεί να είναι, σωστά; Ένας νευρώνας φαίνεται πολύ, πολύ, πολύ διαφορετικός και λειτουργεί πολύ, πολύ διαφορετικά από, ας πούμε, ένα μυϊκό κύτταρο. Τι καθορίζει το πρόγραμμα, το γενετικό πρόγραμμα που επιλέγει να τρέξει ένα κύτταρο; Τι κάνει ένα μυϊκό κύτταρο μυϊκό κύτταρο και τι κάνει έναν νευρώνα νευρώνα;
RICK: Ξεκινήσαμε λοιπόν με το DNA που παράγει RNA και το [RNA] παράγει πρωτεΐνη. Αυτό είναι το κεντρικό δόγμα. Αλλά πριν από περίπου μισό αιώνα, οι επιστήμονες άρχισαν να υποστηρίζουν ότι στην πραγματικότητα το RNA άρχισε να δημιουργεί διάφορα είδη λειτουργιών από μόνο του. Και αποδεικνύεται ότι το RNA έχει πράγματι κάποια από τη δραστηριότητα στα πρώτα στάδια ανάπτυξης.
Όταν το σπέρμα συναντά το ωάριο, είναι το RNA της μητέρας που βάζει σε αυτό το ωάριο. Υπάρχουν μόρια RNA που το κάνουν αυτό. Αποδεικνύεται ότι τα αντιβιοτικά που χρησιμοποιούμε συνήθως συνδέονται με το RNA. Έτσι το RNA έχει μερικούς πολύ σημαντικούς ρόλους εκεί. Αυτό άλλαξε τον τρόπο που σκέφτονται οι άνθρωποι. Στη συνέχεια, καθώς αρχίσαμε να σκεφτόμαστε το ανεπιθύμητο DNA, αυτό είναι το τμήμα του DNA που δεν κωδικοποιεί πρωτεΐνη. Λοιπόν, τι θα συμβεί αν ο κόσμος βασίζεται στο RNA και όχι σε πρωτεΐνη, τουλάχιστον στο αρχή? Και έτσι τώρα καταλαβαίνουμε ότι ένα τεράστιο κλάσμα αυτού που ονομάζουμε ανεπιθύμητο DNA, ή αυτό που ονομάζαμε παλιοπράσινο DNA, δεν είναι σκουπίδια. Είναι εξαιρετικά λειτουργικό. Και το μεγαλύτερο μέρος του παράγει RNA.
Επομένως, ο στόχος σας στον προγραμματισμό οποιουδήποτε κυττάρου είναι να χρησιμοποιήσετε ακριβώς αυτό το συγκεκριμένο σύνολο ακολουθιών που θα συντονίσουν κάθε ένα από αυτό το κοινό σύνολο γονιδίων στο επίπεδο που θέλετε. . . .Το πρόβλημά μας είναι ότι στην πραγματικότητα δεν γνωρίζουμε το πρόγραμμα.
ΧΑΝΕ: Ουάου. Μπορείτε να δείτε λίγο τη χώρα όπου βρισκόμαστε για να κατανοήσουμε το μη κωδικοποιητικό μέρος του DNA; Ξέρετε, ποια είναι η τρέχουσα κατανόηση όλων των διαφορετικών δυνατοτήτων εκεί;
RICK: Μόνο το 2% του γονιδιώματός μας κωδικοποιεί αυτές τις αλληλουχίες αμινοξέων που πηγαίνουν στις πρωτεΐνες. Τι υπάρχει λοιπόν στο λογιστικό μας βιβλίο για το τι κάνουν οι υπόλοιποι;
Περίπου το ήμισυ του γονιδιώματός μας είναι αυτό που ονομάζουμε ετεροχρωματίνη. Εκεί παίρνετε τα προϊόντα των αρχαίων ιογενών εισβολών. Οι αρχαίοι ρετροϊοί εισέβαλαν και στη συνέχεια μετατράπηκαν σε DNA και εισήχθησαν στο γονιδίωμα. Αυτό είναι στην πραγματικότητα ένα μέσο που είχαμε σε όλη την εξελικτική μας ιστορία για να κρύψουμε ακολουθίες που δεν θέλουμε να αντιμετωπίσουμε. Και παραμένει σιωπηλή στο γονιδίωμά μας με μια σημαντική εξαίρεση.
Το άλλο μισό είναι όπου βρίσκονται όλα τα ενεργά πρωτεϊνικά γονίδια που κωδικοποιούν και όπου βρίσκονται όλα τα ενεργά μη κωδικοποιητικά γονίδια. Λοιπόν, τι κάνει; Έχει μια μακρά λίστα ρυθμιστικών λειτουργιών, αλλά θα την απλοποιήσω σε τρεις.
Μία από τις λειτουργίες του είναι η συντήρηση των χρωμοσωμάτων. Έτσι, αυτά είναι τα μέρη όπου συμβαίνει η αντιγραφή του DNA. Είναι οι θέσεις στο γονιδίωμά μας που είναι υπεύθυνες για την αναδίπλωση, επειδή είναι ένα πολυμερές μήκους 2 μέτρων. Πρέπει να διπλωθεί σε έναν πυρήνα διαμέτρου δύο μικρών.
Η δεύτερη ρυθμιστική περιοχή είναι όλα αυτά τα πράγματα που είναι υπεύθυνα για τη ρύθμιση των γονιδίων. Πιθανώς πολύ περισσότερο από το γονιδίωμα καθορίζει ρυθμιστικά χαρακτηριστικά για τη γονιδιακή έκφραση από ό,τι καθορίζει τα ίδια τα γονίδια. Και αυτό γιατί κάθε κύτταρο χρησιμοποιεί διαφορετική ρυθμιστική περιοχή για κάθε γονίδιο.
HANNE: Είναι τόσο ενδιαφέρον, μου ακούγεται λίγο σχεδόν σαν να υπάρχει η ντουλάπα με τα ράφια με πράγματα που πρέπει να βάλουμε στη ντουλάπα για λίγο, και μετά υπάρχει η ντουλάπα της υποδομής.
Γιατί είναι σημαντικό να εστιάσουμε τόσο πολύ σε αυτό; Επειδή εκεί εμφανίζεται πάνω από το 75% όλων των γενετικών παραλλαγών που σχετίζονται με την ασθένεια.
RICK: Ναι. Βασικά, αυτό που έχετε είναι ένα κοινό σύνολο γονιδίων σε κάθε κύτταρο, τόσο κωδικοποιώντας όσο και μη. Και έχετε στοιχεία, έχετε πραγματικές ακολουθίες που λειτουργούν μόνο σε συγκεκριμένους τύπους κυττάρων. Έτσι, ο στόχος σας στον προγραμματισμό οποιουδήποτε κυττάρου είναι να χρησιμοποιήσετε ακριβώς αυτό το συγκεκριμένο σύνολο ακολουθιών που θα συντονίζουν κάθε ένα από αυτό το κοινό σύνολο γονιδίων στο επίπεδο που θέλετε. Παίζετε λοιπόν ένα καταπληκτικό μουσικό όργανο με 20,000 γονίδια κωδικοποίησης πρωτεϊνών και περίπου τον ίδιο αριθμό μη κωδικοποιημένων γονιδίων. Το κάνετε αυτό μέσα από συγκεκριμένες ακολουθίες. Το πρόβλημά μας είναι ότι στην πραγματικότητα δεν γνωρίζουμε το πρόγραμμα.
Πειράγματα του ρυθμιστικού προγράμματος
HANNE: Λοιπόν, πώς θα αρχίσετε να το υπονοείτε; Ποιες είναι οι συμβουλές που ακολουθείτε όταν αρχίζετε να προσπαθείτε να κατανοήσετε αυτό το πρόγραμμα;
RICK: Οι υποδείξεις είναι ότι οι ρυθμιστικές περιοχές για κάθε γονίδιο σε ένα κύτταρο εμφανίζονται. Σου λένε. Και μπορείτε να χρησιμοποιήσετε διάφορες τεχνολογίεςΑυτό σας λέει πολύ γρήγορα σε ολόκληρο το γονιδίωμα, σε έναν συγκεκριμένο τύπο κυττάρου, ας πούμε σε έναν κινητικό νευρώνα, ποιες είναι όλες οι ρυθμιστικές περιοχές που βρίσκονται σε αυτό το κύτταρο. Μπορείτε ακόμη να δείτε πού έχει ρυθμιστεί ο ρεοστάτης για καθένα από αυτά τα γονίδια. Εκεί είναι που η ταχεία αλληλούχιση μας έδωσε αυτές τις δυνατότητες να συνάγουμε ταυτόχρονα όλα τα ενεργά στοιχεία για τα γονίδια, τόσο κωδικοποιητικά όσο και μη στο γονιδίωμα ενός συγκεκριμένου τύπου κυττάρου.
Το πρόβλημά μας αυτή τη στιγμή είναι ότι πρέπει να κάνετε αυτό σχεδόν έναν τύπο κυττάρου τη φορά, και έχουμε πολλές, πολλές εκατοντάδες τύπους κυττάρων. Μερικές φορές είναι δύσκολο να δούμε πραγματικά ένα συγκεκριμένο κύτταρο χωρίς να μολυνθεί με άλλα κύτταρα, επειδή όλοι οι ιστοί μας είναι πραγματικά συνδυασμοί πολλαπλών τύπων κυττάρων.
ΧΟΡΧΕ: Αξίζει να επιχειρηματολογήσουμε κατ' αναλογία αν λέγαμε ότι, δεδομένου ότι κάθε κύτταρο έχει ολόκληρο το γονιδίωμα, κάθε κύτταρο έχει ολόκληρο το τραγούδι, συγκεκριμένοι τύποι κυττάρων επιλέγουν να παίξουν συγκεκριμένες συμφωνίες και ο μηχανισμός που βοηθά στη ρύθμιση του γονιδιώματος είναι ουσιαστικά ο αγωγός του η ορχήστρα; Αυτός ο μηχανισμός είναι ο μαέστρος που καθορίζει ποια τραγούδια θα παίξει, ποιες νότες θα χτυπήσει, με ποια ένταση θα χτυπήσει, σε ποιο ρυθμό κ.λπ. Είναι αυτή μια λογική αναλογία με την κατανόηση της ρυθμιστικής λειτουργίας του γονιδιώματος;
RICK: Είναι υπό την έννοια ότι είναι εύκολο να δει κανείς ποια θα είναι η έξοδος. Αλλά αυτό που είναι πιο δύσκολο είναι, ποιος γράφει όλες τις σημειώσεις; Ποιος είναι ο συνθέτης που έβαλε όλες αυτές τις νότες εκεί και τα κατάφερε; Ο συνθέτης αποδεικνύεται ότι είναι, για τα περισσότερα από τα κύτταρά μας και τα περισσότερα γονίδιά μας, αυτά τα πρωτεϊνικά μόρια που ονομάζονται παράγοντες μεταγραφής, των οποίων η δουλειά είναι να συνδέονται με τα ρυθμιστικά στοιχεία των γονιδίων και να τους δίνουν μια ρύθμιση ρεοστάτη.
Τώρα, υπάρχει μια ενδιαφέρουσα ρυτίδα σε αυτό γιατί σε εκείνες τις τοποθεσίες όπου αυτοί οι παράγοντες μεταγραφής συνδέονται, τους ονομάζουμε ενισχυτικό. Σε αυτές τις θέσεις ενισχυτών, υπάρχει επίσης πάντα ένα RNA που δημιουργείται από αυτή τη θέση όπου είναι συνδεδεμένα. Μόλις πρόσφατα καταλάβαμε ότι το RNA παίζει σημαντικό ρόλο στη ρύθμιση. Απλώς για να το ενισχύσουμε: ο τρόπος με τον οποίο το iPhone σας αναγνωρίζει το πρόσωπό σας είναι επειδή οι ενισχυτές που ελέγχουν τα γονίδια της δομής του κρανιακού προσώπου ποικίλλουν σε κάθε άνθρωπο.
Αυτό που έχετε τώρα εδώ είναι αυτή η τριάδα. Έχετε την αλληλουχία του DNA. Αναγνωρίζεται συγκεκριμένα από το μόριο σύνθεσης, τον παράγοντα μεταγραφής, αλλά χρειάζεται αυτό το τρίτο κομμάτι, αυτό το μόριο RNA. Έτσι το DNA, το RNA και η πρωτεΐνη λειτουργούν μαζί σε αυτές τις ρυθμιστικές περιοχές. Και γιατί είναι σημαντικό να εστιάσουμε τόσο πολύ σε αυτό; Διότι εκεί εμφανίζεται πάνω από το 75% όλων των γενετικών παραλλαγών που σχετίζονται με την ασθένεια.
HANNE: Για να μην γίνω πολύ νευρικός μουσικά, αλλά ακούγεται σχεδόν σαν συγχορδία, σωστά; Η δομή των τριών νότων παίζουν όλα μαζί για να δημιουργήσουν κάτι μεγαλύτερο.
RICK: Έτσι είναι.
Οι προγραμματιστές
ΧΟΡΧΕ: Ένας από τους πιο προηγμένους τομείς της βιολογίας είναι η αυξανόμενη ικανότητά μας να προσπαθούμε να κατανοήσουμε ορισμένους από τους νόμους που διέπουν το πώς καθορίζονται τα κυτταρικά προγράμματα, πώς καθορίζεται η μοίρα των κυττάρων. Για μένα ένα από τα συναρπαστικά άλματα προς τα εμπρός στην κατανόησή μας, προήλθε από τη δουλειά που έκανε ο Yamanaka, για την οποία του απονεμήθηκε το βραβείο βραβείο Νόμπελ, αποδεικνύοντας ότι θα μπορούσατε να επαναπρογραμματίσετε τύπους κυττάρων εκθέτοντας απλώς κύτταρα σε μια πολύ μικρή χούφτα συγκεκριμένων παραγόντων μεταγραφής.
HANNE: Μπορείτε να περιγράψετε γιατί ήταν μια τέτοια σημαντική ανακάλυψη για τον χώρο;
RICK: Είχα έναν μικρό ρόλο σε εκείνη την ταινία. Αποδεικνύεται ότι αν και αυτός είναι ένας πολύ μεγάλος αριθμός, ένας μικρός αριθμός μεταγραφικών παραγόντων μπορεί να προσδιορίσει όλα τα ρυθμιστικά στοιχεία που είναι απαραίτητα για την ταυτότητα αυτού του κυττάρου. Και ο Yamanaka μας το απέδειξε αυτό δείχνοντας ότι μόνο τέσσερις από αυτούς τους παράγοντες θα μπορούσαν να χρησιμοποιηθούν για να προγραμματίσουν οποιοδήποτε ανθρώπινο κύτταρο ή οποιοδήποτε αρσενικό κύτταρο στο ισοδύναμο ενός εμβρυϊκού βλαστοκυττάρου.
Ένας τρόπος να το σκεφτείς αυτό είναι, αν το τραγούδι είναι πολύ κακό, ο οργανισμός δεν ζει. Αλλά αν είναι λίγο μακριά, μεγαλώνεις, ενηλικιώνεσαι και μετά αποκτάς όλες αυτές τις διάφορες ασθένειες καθώς μεγαλώνουμε.
ΧΟΡΧΕ: Και αυτό είναι καταπληκτικό, σωστά; Διότι αυτό υποδηλώνει ότι το σύστημα έχει σχεδιαστεί κατά κάποιο τρόπο όπου η απίστευτη πολυπλοκότητα αντλείται από αυτό που ακούγεται σαν απλότητα. Τέσσερις μεταγραφικοί παράγοντες που καθορίζουν όλη τη σύνθετη σειρά γεγονότων που διέπουν διαφορετικούς τύπους κυττάρων.
Ορισμένες από τις εργασίες που έχετε κάνει έχει δείξει ότι αυτοί οι κύριοι παράγοντες μεταγραφής ουσιαστικά δημιουργούν το ισοδύναμο κυκλωμάτων που ελέγχουν τα γονίδια που είναι απαραίτητα για ένα κύτταρο για να δημιουργήσει και να διατηρήσει την κατάστασή του. Μπορείτε να περιγράψετε τι εννοείτε με τον όρο κυκλώματα ελέγχου γονιδίων;
RICK: Υπάρχουν δύο δροσερά στοιχεία στα κυκλώματα ελέγχου γονιδίων. Το ένα είναι, όταν ένας κύριος ρυθμιστής βρίσκει αυτούς τους ενισχυτές και προκαλεί την έκφραση των γονιδίων-στόχων του, αυτό είναι ένα μέρος του κυκλώματος, αυτό είναι η έξοδος. Το άλλο στοιχείο που είναι τόσο ωραίο είναι ότι οι κύριοι παράγοντες μεταγραφής ρυθμίζουν επίσης τη δική τους έκφραση. Υπάρχει λοιπόν ένας βρόχος ανατροφοδότησης. Όπως, θα έχετε ένα ηλεκτρικό διάγραμμα όπου θα έχετε τους κύριους να ελέγχουν τη δική τους έκφραση από τα δικά τους γονίδια και στη συνέχεια να δεσμεύουν και να ελέγχουν την έκφραση ενός συνόλου γονιδίων-στόχων.
ΧΟΡΧΕ: Αυτό είναι πολύ άγριο. Είναι σχεδόν σαν μια κυκλική αναφορά, όπου οι παράγοντες μεταγραφής είναι πρωτεΐνες, αυτή η πρωτεΐνη παράγεται από DNA, κωδικοποιημένο σε ένα γονίδιο. Οι παράγοντες μεταγραφής είναι μέρος του μηχανισμού που βοηθά την έκφραση στη μεταγραφή των γονιδίων. Και επομένως, λέτε ότι οι μεταγραφικοί παράγοντες –η πρωτεΐνη– βοηθούν στη ρύθμιση της έκφρασης των γονιδίων που δημιουργούν τους μεταγραφικούς παράγοντες.
HANNE: Ναι. Υπάρχει μια διανοητική εικόνα όλης αυτής της συμφωνίας όλων αυτών των μικρών κυττάρων, ξέρετε, που τραγουδούν όλες αυτές τις διαφορετικές υφές.
Το ρυθμιστικό γονιδίωμα και ασθένεια
HANNE: Τι αλλάζει όταν αρχίζουμε να καταλαβαίνουμε πώς λειτουργεί όλο αυτό; Τι μπορούμε να κάνουμε με αυτή τη γνώση;
RICK: Αυτές οι τοποθεσίες όπου αυτοί οι κύριοι παράγοντες μεταγραφής καθοδηγούν την ταυτότητα κάθε κυττάρου είναι όπου το μεγαλύτερο μέρος της ανθρώπινης διαφοροποίησης προκαλεί ασθένεια. Πάνω από το 75% των παραλλαγών που σχετίζονται με την ασθένεια εμφανίζεται σε αυτά τα ενισχυτικά στοιχεία που οδηγούν τα βασικά γονίδια.
ΧΟΡΧΕ: Εντάξει. Λοιπόν αυτό είναι άγριο, σωστά; Όταν σκεφτόμαστε μεταλλάξεις που προκαλούν ή συμβάλλουν σε ασθένεια, συνήθως σκεφτόμαστε μια μετάλλαξη που συμβαίνει σε ένα γονίδιο που επηρεάζει την πρωτεΐνη, με κάποιο τρόπο διασπά την πρωτεΐνη και που προκαλεί ασθένεια.
ΧΑΝΕ: Σωστά.
ΧΟΡΧΕ: Αλλά λέτε ότι στο 75% των περιπτώσεων, αυτή η μετάλλαξη συμβαίνει στην πραγματικότητα εκτός των γονιδίων, συμβαίνει σε αυτή τη μη κωδικοποιητική περιοχή του γονιδιώματος. Εάν το γονίδιο είναι το τραγούδι, δεν είναι ότι το τραγούδι παίζεται λάθος, είναι ότι μπορεί να παίζεται πολύ δυνατά, ή πολύ απαλά, ή πολύ αργά ή πολύ γρήγορα, αλλά αυτό είναι που οδηγεί πολλές ασθένειες.
RICK: Στην πραγματικότητα, ένας τρόπος να το σκεφτείς αυτό είναι, αν το τραγούδι είναι πολύ κακό, ο οργανισμός δεν ζει. Αλλά αν είναι λίγο μακριά, μεγαλώνεις, ενηλικιώνεσαι και μετά αποκτάς όλες αυτές τις διάφορες ασθένειες καθώς μεγαλώνουμε.
Για πρώτη φορά, έχουμε όλα αυτά τα μοντέλα για τον τρόπο ρύθμισης και λειτουργίας της συσκευής.
ΧΟΡΧΕ: Δεν φτιάχνω τη λάθος εκδοχή του γονιδίου, αλλά λαμβάνω τη λάθος δοσολογία του γονιδίου. Πάρα πολύ ή πολύ λίγο.
RICK: Αυτό είναι σωστό. Πώς βρίσκετε θεραπείες που αντιμετωπίζουν αυτό; Πώς συντονίζετε επιλεκτικά ή μειώνετε το γονίδιο; Κατ' αρχήν, μπορούμε να το κάνουμε αυτό με πολλούς τρόπους, και μπορούμε να το κάνουμε με τη γονιδιακή θεραπεία. Μπορούμε να το κάνουμε αυτό με την επεξεργασία γονιδίων CRISPR. Αλλά το πιο σημαντικό πράγμα που νομίζω ότι έχουμε ανακαλύψει τα τελευταία χρόνια είναι ότι κάθε ένα από αυτά τα γονιδιακά ρυθμιστικά στοιχεία έχει ένα RNA. Το RNA είναι λειτουργικό. Είναι ένας ρεοστάτης που βοηθά στη ρύθμιση της παραγωγής αυτού του γονιδίου. Τώρα υπάρχουν πολλοί τρόποι που μπορείτε RNA φαρμάκων. Εχουμε ASOs (αντιπληροφοριακά ολιγονουκλεοτίδια), όπως το Spinraza για νωτιαία μυϊκή ατροφία. Έχουμε παρεμβολή RNA. Έχουμε μερικά νέα μικρομοριακά φάρμακα στον ορίζοντα. Εάν μπορούσατε να σκεφτείτε τρόπους για να προγραμματίσετε τώρα ένα φάρμακο, ένα συνθετικό RNA, για να ρυθμίσετε το ρυθμιστικό RNA, το ρυθμιστικό RNA, έχετε τον κύριο τρόπο συντονισμού οποιουδήποτε γονιδίου σε οποιοδήποτε κύτταρο όπου αυτό το κύτταρο μπορεί να αποκτήσει πρόσβαση σε αυτό το φάρμακο.
HANNE: Επομένως, δεν είναι απλώς μια εντελώς διαφορετική κατανόηση του πώς εμφανίζεται η ασθένεια. Αλλά είναι μια εντελώς διαφορετική αντίληψη για το πώς θα μπορούσαμε δυνητικά να αντιμετωπίσουμε την ασθένεια.
RICK: Ακριβώς. Κατ' αρχήν, έχουμε τώρα έναν προγραμματιζόμενο τρόπο ανάπτυξης ενός φαρμάκου που συντονίζει οποιοδήποτε γονίδιο ενδιαφέροντος. Αυτή τη στιγμή, οι άνθρωποι απλώς προγραμματίζουν συνθετικά μόρια RNA για να παράγουν ένα εμβόλιο για αυτήν την πανδημία. Ένα εμβόλιο που είναι τόσο καλό όσο θα περίμενες ποτέ για ένα εμβόλιο.
ΧΟΡΧΕ: Όταν σκεφτόμαστε τις εφαρμογές του τεχνολογία στη βιολογία, συνήθως προσπαθούμε να κάνουμε ένα από τα δύο πράγματα. Είτε προσπαθούμε να ανακρίνουμε τη βιολογία πολύ βαθιά και να την κατανοήσουμε, αυξάνοντας τα επίπεδα της πολυπλοκότητάς της, είτε προσπαθούμε να παρέμβουμε. Είμαστε όλο και περισσότερο σε θέση να ανακρίνουμε τη βιολογία σε ένα πολύ, πολύ βαθύ επίπεδο, ώστε να κατανοούμε τους νόμους ή τους κανόνες που διέπουν τον τρόπο με τον οποίο ρυθμίζονται τα κύτταρα. Και το έχουμε αυτό, έχουμε όλο και πιο εξελιγμένα εργαλεία, όπως αυτά προγραμματιζόμενες μεθόδους ιατρικής, όπου μπορούμε να στοχεύσουμε το RNA, πολύ, πολύ συγκεκριμένα. Αυτός θα είναι κάπως αυτός ο ενάρετος κύκλος μεταξύ της ικανότητάς μας να ανακρίνουμε τη βιολογία και στη συνέχεια να παρεμβαίνουμε με ολοένα και πιο εξελιγμένους τρόπους. Και νομίζω ότι αυτή είναι μια από τις πιο συναρπαστικές πτυχές του πού βρισκόμαστε σήμερα σε αυτόν τον τομέα.
RICK: Συμφωνώ μαζί σου. Τώρα αναπτύσσουμε μια τόσο βαθιά κατανόηση των πολλαπλών στρωμάτων πολυπλοκότητας, που μπορούμε να καταλήξουμε σε θεραπευτικές υποθέσεις που δεν έχουμε ξαναδεί. Μπορούμε να τα κάνουμε με μια ταχύτητα που δεν είχαμε ποτέ φανταστεί πριν από λίγα χρόνια. Αυτή η χρονική απόσταση μεταξύ μιας βασικής ανακάλυψης και της θεραπείας που έγινε στους ανθρώπους πριν από 10 χρόνια ήταν 14 χρόνια κατά μέσο όρο. Τώρα, είναι κατανοητό να σκεφτούμε την ανάπτυξη μιας θεραπευτικής υπόθεσης βασισμένης στη βασική επιστήμη και μιας θεραπείας που φτάνει στον ασθενή σε εννέα μήνες. είμαστε βλέποντας ότι με αυτό το νέο εμβόλιο.
HANNE: Αλλάζοντας, λοιπόν, όχι μόνο τον τρόπο με τον οποίο κατανοούμε την εμφάνιση της νόσου, τον τρόπο που την αντιμετωπίζουμε, αλλά και τον τρόπο με τον οποίο κάνουμε την ίδια την επιστήμη και, στη συνέχεια, πόσο γρήγορα μπορεί να συμβεί η επιστήμη και να μετατραπεί σε κλινική πραγματικότητα για τους ασθενείς.
RNA ως διαμερισματοποιητής
RICK: Ακριβώς. Αλλά τώρα υπάρχει κερασάκι στην τούρτα γιατί, κλασικά, έχουμε σκεφτεί τη φαρμακολογία με δύο τρόπους. Το ένα ήταν η επίδραση του φαρμάκου στο άτομο. Το άλλο ήταν η επίδραση του ατόμου στο φάρμακο. Και σε αυτό το τελευταίο τμήμα, ανησυχείτε για τη διανομή του φαρμάκου, σε ποιους ιστούς πηγαίνει, σε ποιους ιστούς δεν είναι διαθέσιμο. Επειδή απλώς υποθέτουμε ότι μόλις ένα φάρμακο εισέλθει σε ένα κύτταρο, διαχέεται μέσα στο κύτταρο και βρίσκει τον στόχο του. Έχουμε διαμερίσματα συνδεδεμένα με μεμβράνη, τα οποία γνωρίζουμε εδώ και έναν αιώνα.
ΧΟΡΧΕ: Ποιο ήταν πάντα το ζήτημα της διαπερατότητας των κυττάρων, σωστά; Μπορεί να διασχίσει τη μεμβράνη;
RICK: Ναι. Μπορεί να διασχίσει μια μεμβράνη και μπαίνει στον πυρήνα ή όχι; Αλλά καταλάβαμε μόλις την τελευταία δεκαετία ότι υπάρχουν επίσης πολλά μη μεμβρανικά σώματα στα κύτταρα που ονομάζονται βιομοριακά συμπυκνώματα επειδή πιστεύεται ότι ένας λόγος για τον οποίο σχηματίζονται αυτά τα σώματα είναι ότι συμπυκνώνονται όπως το νερό συμπυκνώνεται σε μια σταγόνα δροσόσου. Αλλά αυτό που ήταν τόσο βαθύ σχετικά με αυτήν την κατανόηση είναι ότι αυτά τα συμπυκνώματα διαμερίζουν πρωτεΐνες, DNA, RNA για συγκεκριμένες λειτουργίες. Και έτσι τώρα καταλάβαμε ότι μπορείτε να διαχωρίσετε τα 5 έως 10 δισεκατομμύρια μόρια πρωτεΐνης και RNA σε ένα κύτταρο σε διάφορα διαμερίσματα όπου λειτουργούν με τους φίλους τους.
ΧΑΝΕ: Χα.
ΧΟΡΧΕ: Αφήνουμε τη σφαίρα της βιολογίας και μπαίνουμε στη σφαίρα της φυσικής;
RICK: Κάναμε ακριβώς αυτό γιατί ο διαχωρισμός φάσης θεωρείται ότι είναι η κινητήρια δύναμη. Αυτό είναι ένα φυσικό φαινόμενο που περιγράφεται από τα μαθηματικά.
ΧΑΝΕ: Ουάου.
RICK: Τώρα, μάθαμε τα πιο αποτελεσματικά χημειοθεραπευτικά φάρμακα συγκεντρωτικός μέσα στα διαμερίσματα όπου ζουν οι στόχοι τους. Συγκεντρώνονται 600 φορές πάνω από το υπόλοιπο κύτταρο, επομένως έχουν δραστηριότητα επί στόχου στα ογκογονίδια που είναι 600 φορές μεγαλύτερη από αυτή που περιμέναμε. Αυτό όχι μόνο μας λέει ότι υπάρχουν ολοκαίνουργιες ιδέες που είναι σημαντικές για την ανακάλυψη και την ανάπτυξη φαρμάκων για το μέλλον, αλλά μας κάνει να θέλουμε να κατανοήσουμε καλύτερα τι κάνουν αυτά τα συμπυκνώματα.
Να τι εννοώ με το κερασάκι στην τούρτα. Αυτό που καταλάβαμε είναι ότι αυτά τα διαμερίσματα συμπυκνώματος που λειτουργούν το κύτταρο με τόσο σημαντικούς τρόπους ρυθμίζονται από το RNA. Ο σχηματισμός τους μπορεί να διεγερθεί από το RNA. Εάν παράγετε πάρα πολύ RNA, φέρετε τον ρεοστάτη στο 11, θα διαλύσει ένα συμπύκνωμα. Έτσι, ξαφνικά, συνειδητοποιούμε ότι η έξοδος RNA σε οποιαδήποτε θέση μέσα σε ένα κύτταρο μπορεί να συντονίσει τη λειτουργία οποιουδήποτε στοιχείου ενισχύοντας ή διαλύοντας αυτά τα συμπυκνώματα όπου συμβαίνει αυτή η λειτουργία. Και αυτό είναι, νομίζω, βαθύ γιατί είναι ένας άλλος τρόπος με τον οποίο ένα προγραμματιζόμενο RNA, ένα συνθετικό μόριο RNA, μπορεί να χρησιμοποιηθεί για να συντονιστεί η λειτουργία ενός κυττάρου που έχει γίνει δυσλειτουργικό. Για πρώτη φορά, έχουμε όλα αυτά τα μοντέλα για τον τρόπο ρύθμισης και λειτουργίας της συσκευής.
HANNE: Άλλο ένα κουμπί για να καλέσετε.
RICK: Αλλά τότε πώς το απενεργοποιείς; Αποδεικνύεται ότι όταν δημιουργείτε αυτό το μακρύ RNA, αυτό είναι απλώς μια μεγάλη σειρά αρνητικών φορτίων, και διαλύει το συμπύκνωμα και κλείνει το γονίδιο. Έτσι ρυθμίζονται τα γονίδια. Συντονίζετε το συμπύκνωμα με ένα RNA και μετά το κλείνετε με το προϊόν RNA που δημιουργείται όταν το γονίδιο μεταγραφεί πλήρως.
ΧΑΝΕ: Υπέροχα. Οπότε ένας διακόπτης απενεργοποίησης και ενεργοποίησης, πραγματικά.
RICK: Είναι ένας διακόπτης off/on που κανείς δεν περίμενε. Και σημαίνει, για άλλη μια φορά, εάν έχετε ένα προγραμματιζόμενο φάρμακο, έχετε έναν νέο τρόπο στόχευσης κυτταρικών λειτουργιών που είναι δυσλειτουργικές, μια νέα λύση για ένα θεραπευτικό πρόβλημα.
ΧΟΡΧΕ: Το παλιό DNA ενός ανθρώπου είναι ο εξελιγμένος ρυθμιστικός μηχανισμός του γονιδιώματος ενός άλλου.
ΧΑΝΕ: Ή του καθενός.
Δημοσιεύτηκε στις 15 Ιουλίου 2022
Τεχνολογία, καινοτομία και μέλλον, όπως είπαν όσοι την κατασκευάζουν.
- Andreessen Horowitz
- Βιο & Επιστήμη
- Bitcoin
- blockchain
- συμμόρφωση με το blockchain
- blockchain συνέδριο
- coinbase
- Coingenius
- Ομοφωνία
- crypto συνέδριο
- εξόρυξη κρυπτογράφησης
- cryptocurrency
- Αποκεντρωμένη
- Defi
- Ψηφιακά περιουσιακά στοιχεία
- ethereum
- μάθηση μηχανής
- μη εύφλεκτο διακριτικό
- Πλάτων
- πλάτων αι
- Πληροφορία δεδομένων Plato
- Πλανοσάτσας
- Πλάτωνα δεδομένα
- platogaming
- Πολύγωνο
- απόδειξη συμμετοχής
- W3
- zephyrnet