Uut tüüpi arvutimudel, mis võib paljastada kiirguskahjustusi rakutasandil, võib parandada kopsuvähiga patsientide kiiritusravi tulemusi.
Roman Bauer, arvutuslik neuroteadlane Surrey ülikool Ühendkuningriigis koostöös Marco Durante ja Nicolò Cogno Alates GSI Helmholtzzentrum für Schwerionenforschung Saksamaal lõi mudeli, mis simuleerib kiirguse vastasmõju kopsudega rakupõhiselt.
Üle poole kõigist kopsuvähiga patsientidest saavad kiiritusravi. Kuigi see lähenemisviis on tõhus, jätab see kuni 30% vastuvõtjatest kiirgusest põhjustatud vigastuste alla. Need võivad põhjustada tõsiseid hingamist mõjutavaid seisundeid, nagu fibroos – mille puhul kopsude alveoolide (õhukottide) vooder on paksenenud ja jäigastunud – ja kopsupõletik – kui alveoolide seinad muutuvad põletikuliseks.
Tervete kudede kiirguskahjustuste piiramiseks, tappes samal ajal vähirakke, manustatakse kiiritusravi mitmes eraldi "fraktsioonis". See võimaldab üldiselt manustada suuremat – ja seega ka tõhusamat – annust, sest mõned kahjustatud terved rakud saavad end iga fraktsiooni vahel parandada.
Praegu valitakse kiiritusravi fraktsioneerimisskeemid varasemate kogemuste ja üldistatud statistiliste mudelite põhjal, mistõttu neid ei optimeerita üksikute patsientide jaoks. Seevastu personaliseeritud meditsiin on saavutatav tänu sellele uuele mudelile, mis, nagu Durante, direktor GSI biofüüsika osakond selgitab, vaatleb "toksilisust kudedes alates raku põhireaktsioonidest ja suudab seetõttu ennustada, mis juhtub mis tahes patsiendiga", kui valitakse erinevad fraktsioneerimisskeemid.
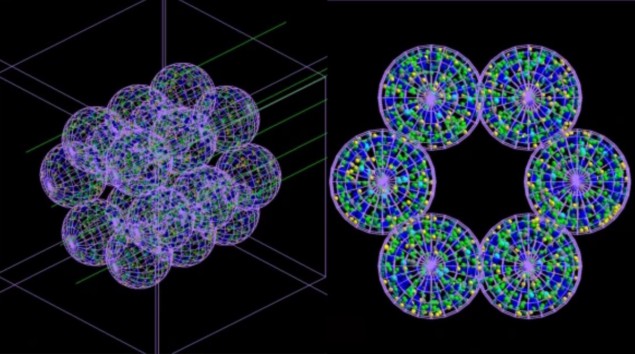
Meeskond töötas välja "agendipõhise" mudeli (ABM), mis koosneb eraldi interakteeruvatest üksustest või ainetest - mis antud juhul jäljendavad kopsurakke - koos Monte Carlo simulaatoriga. ABM, mida on kirjeldatud aastal Sidemeditsiin, loob alveolaarse segmendi kujutise, mis koosneb 18 alveoolist, millest igaüks on 260 µm läbimõõduga. Järgmisena viiakse nende alveoolide kiiritamise Monte Carlo simulatsioonid läbi mikroskoopilisel ja nanoskoopilisel skaalal ning teave igasse rakku edastatud kiirgusdoosi ja selle jaotuse kohta suunatakse tagasi ABM-i.
ABM kasutab seda teavet, et välja selgitada, kas iga rakk jääb ellu või sureb, ja väljastab lõpptulemused 3D-pildi kujul. Oluline on see, et ühendatud mudel võib simuleerida aja möödumist ja seega näidata kiirguskahjustuse raskust – ja selle põhjustatud haigusseisundite progresseerumist – tunde, päevi, kuid või isegi aastaid pärast ravi.
"Mis ma leidsin väga põnevaks, on see, et need arvutuslikud simulatsioonid andsid tegelikult tulemusi, mis sobisid erinevate rühmade, laborite ja haiglate erinevate eksperimentaalsete vaatlustega. Nii et meie arvutuslikku lähenemist võiks põhimõtteliselt kasutada kliinilises keskkonnas,“ ütleb Bauer, rahvusvahelise organisatsiooni pressiesindaja. BioDynaMo koostöö, mille eesmärk on tuua selle mudeli koostamiseks kasutatud tarkvarakomplekti kaudu tervishoiusse uusi arvutusmeetodeid.
Bauer alustas arvutuslike vähimudelite kallal töötamist pärast seda, kui lähedane sõber suri haiguse tagajärjel vaid 34-aastaselt. "Iga vähk on erinev ja iga inimene on erinev, erineva kujuga elundite, geneetiliste eelsoodumuste ja eluviisidega," selgitab ta. Tema lootus on, et skaneeringutest, biopsiatest ja muudest testidest saadud teavet saab uude mudelisse sisestada, et luua pilt igast inimesest. Seejärel võiks luua AI-abiga raviprotokolli, mis annaks välja täpselt kohandatud raviplaani, mis parandab patsiendi ellujäämisvõimalusi.
Patsiendipõhine planeerimine võib parandada kiiritusravi tulemusi
Bauer otsib praegu kaastöötajaid teistest teadusharudest, sealhulgas füüsikast, et aidata liikuda kliinilise uuringu poole pärast kopsuvähiga patsiente mitme aasta jooksul. Vahepeal kavatseb meeskond laiendada mudeli kasutamist teistesse meditsiinivaldkondadesse.
Näiteks Durante loodab selle kopsumudeliga uurida viirusnakkust, kuna see "võib ennustada COVID-19 infektsioonist põhjustatud kopsupõletikku". Vahepeal on Bauer hakanud simuleerima ahelate arengut enneaegsete imikute ajus, eesmärgiga paremini mõista, "mis ajahetkel sekkuda ja kuidas".
- SEO-põhise sisu ja PR-levi. Võimenduge juba täna.
- PlatoData.Network Vertikaalne generatiivne Ai. Jõustage ennast. Juurdepääs siia.
- PlatoAiStream. Web3 luure. Täiustatud teadmised. Juurdepääs siia.
- PlatoESG. Süsinik, CleanTech, Energia, Keskkond päikeseenergia, Jäätmekäitluse. Juurdepääs siia.
- PlatoTervis. Biotehnoloogia ja kliiniliste uuringute luureandmed. Juurdepääs siia.
- Allikas: https://physicsworld.com/a/modelling-lung-cells-could-help-personalize-radiotherapy/
- :on
- :on
- :mitte
- $ UP
- 135
- 3d
- a
- Võimalik
- MEIST
- AC
- saavutada
- tegelikult
- manustatud
- mõjutada
- pärast
- vananenud
- ained
- Eesmärgid
- AIR
- Materjal: BPA ja flataatide vaba plastik
- võimaldab
- Kuigi
- an
- ja
- mistahes
- lähenemine
- OLEME
- valdkondades
- AS
- At
- tagasi
- põhineb
- põhiline
- alus
- BE
- sest
- muutuma
- hakkas
- alanud
- Parem
- vahel
- hingamine
- tooma
- ehitama
- Ehitab
- by
- CAN
- vähk
- Vähirakud
- kaasas
- juhul
- Põhjus
- rakk
- Rakke
- vastuolu
- valitud
- kliiniline
- lähedal
- lähedalt
- koostöö
- koostööpartnerid
- arvutuslik
- arvuti
- Tingimused
- Koosneb
- kontrast
- võiks
- seotud
- Covid-19
- loodud
- otsustaval
- Praegu
- kahju
- Päeva
- esitatud
- osakond
- kirjeldatud
- arenenud
- & Tarkvaraarendus
- Surema
- suri
- erinev
- Juhataja
- erialadel
- haigus
- jaotus
- annus
- iga
- Tõhus
- Isegi
- Iga
- põnev
- Laiendama
- kogemus
- eksperimentaalne
- Selgitab
- Toidetud
- lõplik
- Järel
- eest
- vorm
- avastatud
- murdosa
- sõber
- Alates
- üldistatud
- geneetiline
- Saksamaa
- eesmärk
- Grupi omad
- Pool
- juhtub
- he
- tervishoid
- tervislik
- aitama
- rohkem
- tema
- lootus
- lootes
- haiglad
- Lahtiolekuajad
- Kuidas
- HTTPS
- i
- parandama
- parandab
- in
- Kaasa arvatud
- eraldi
- info
- vigastused
- Näiteks
- kavatseb
- suhtlevad
- interaktiivne
- rahvusvaheliselt
- vahele segama
- sisse
- probleem
- IT
- ITS
- jpg
- lihtsalt
- tapmine
- Labs
- Tase
- eluviiside
- LIMIT
- vooder
- elama
- välimus
- sobitatud
- max laiuse
- mai..
- Vahepeal
- meditsiini-
- meditsiin
- meetodid
- mikroskoopiline
- mudel
- modelleerimine
- mudelid
- kuu
- rohkem
- liikuma
- loodus
- Uus
- järgmine
- of
- on
- optimeeritud
- or
- et
- Muu
- meie
- välja
- tulemusi
- väljund
- väljundid
- üle
- üldine
- läbipääsu
- minevik
- patsient
- patsientidel
- inimene
- personaliseerida
- Isikliku
- Füüsika
- Füüsika maailm
- pilt
- kava
- planeerimine
- Platon
- Platoni andmete intelligentsus
- PlatoData
- Punkt
- ennustada
- Enneaegne
- põhimõte
- progressioon
- protokoll
- anda
- Radioteraapia
- reaktsioonid
- saajatele
- remont
- esindamine
- Tulemused
- avalduma
- ütleb
- Skaala
- skaneerib
- skeemid
- otsib
- segment
- eri
- tõsine
- kehtestamine
- mitu
- kujundatud
- näitama
- simuleerima
- simulatsioonid
- simulaator
- So
- tarkvara
- mõned
- pressiesindaja
- Käivitus
- statistiline
- Veel
- Uuring
- selline
- komplekt
- Surrey
- ellujäämine
- kohandatud
- meeskond
- testid
- tänan
- et
- .
- Suurbritannia
- ennast
- SIIS
- ravi
- seetõttu
- Need
- see
- thumbnail
- Seega
- aeg
- et
- suunas
- töödeldud
- ravi
- kohtuprotsess
- vallandada
- tõsi
- tüüp
- Uk
- mõistmine
- üksused
- kasutama
- Kasutatud
- kasutusalad
- kasutamine
- eri
- väga
- kaudu
- viiruslik
- M
- millal
- kas
- mis
- kuigi
- koos
- jooksul
- Töö
- treening
- töö
- maailm
- oleks
- aastat
- sephyrnet