Termoradioteraapia on vähiravi, mille käigus kiiritusravi efektiivsuse suurendamiseks kasutatakse hüpertermiat – kasvaja kuumutamist üle kehatemperatuuri. Selle parenduse suurust väljendatakse EQD-naRT, samaväärne kiirgusdoos, mis on vajalik sama ravitoime saavutamiseks ilma kuumutamata.
Kliinilised uuringud on näidanud, et see lähenemisviis võib oluliselt parandada ravitulemusi mitmete kasvajatüüpide puhul, suurendamata seejuures normaalset kudede toksilisust. Varasemad uuringud näitasid ka, et nii saavutatud temperatuur kui ka kiiritusravi ja hüpertermia vaheline ajavahemik mõjutavad kliinilist tulemust.
Selle protsessi üksikasjalikumaks mõistmiseks ja ravi optimeerimiseks aitavad teadlased aadressil Amsterdami UMC on kasutanud bioloogilist modelleerimist, et uurida maksimaalse temperatuuri ja ajavahemiku mõju EQD-leRT. Nende leidude kirjeldamine dokumendis International Journal of Radiation Oncology Biology Physics, teatavad nad, et nii kõrged temperatuurid kui ka lühikesed ajavahemikud on terapeutilise tõhususe maksimeerimiseks olulised.
Bioloogiline mudel
Termoradioteraapia läbiviimiseks kasutavad arstid raadiosagedus- või mikrolaineseadet, et soojendada kasvajat üks või kaks korda nädalas, kas enne või pärast kiiritusravi seanssi. Kasvaja temperatuuri hoitakse alla 45°C, et vältida normaalsete kudede kuumenemist, kuid mõnikord võivad tekkida soovimatud (ja valulikud) kuumad kohad, mis piiravad hüpertermiaravi ajal kasutatavat maksimaalset talutavat võimsustaset.
Esimene autor Petra Kok ja kolleegid töötasid välja tarkvara kiiritusravi ja hüpertermia bioloogiliste mõjude modelleerimiseks ekvivalentse doosi jaotuse osas. Mudel, mis võtab arvesse DNA parandamise inhibeerimist hüpertermia poolt ja otsest kuumusest põhjustatud tsütotoksilisust, võimaldab hinnata kombineeritud raviplaanide kvaliteeti standardsete annuse-mahu histogrammide abil.
Hüpertermia parameetrite mõjust põhiülevaate saamiseks arvutas meeskond esmalt standardse 23 × 2 Gy annuse jaotuse suurenemise homogeense temperatuuriga vahemikus 37–43 °C ajavahemikus 0–4 tundi.
Mudel näitas, et EQDRT suurenes märkimisväärselt nii temperatuuri tõusuga kui ka ajaintervalli vähenemisega. Näiteks 1-tunnise ajavahemiku jaoks ennustas see EQD-dRT temperatuuri tõus 2–15 Gy võrra 39–43 °C. Need leiud rõhutavad kliinilise tulemuse optimeerimiseks kõrgeima talutava kasvaja temperatuuri saavutamise tähtsust.
Ajavahemiku mõju oli kõige tugevam kõrgematel temperatuuridel (üle 41 °C). Tüüpilise hüpertermilise temperatuuri 41.5 °C korral tekib EQDRT suurenemine umbes 10 Gy saavutati 0-tunnise intervalliga. See vähenes 4-tunnise intervalliga umbes 4 Gy-ni, mis näitab, et ajaintervalli pikenedes on sama efekti saavutamiseks vaja kõrgemat temperatuuri.
Kliinilised juhtumid
Järgmisena hindasid teadlased realistlikke ravistsenaariume, mis põhinesid ebahomogeensetel temperatuurijaotustel ja kliinilistel kiiritusravi plaanidel. Nad arvutasid välja EQDRT 10 lokaalselt levinud emakakaelavähiga patsiendile. Kõik patsiendid olid saanud 23 × 2 Gy mahulist moduleeritud kaarteraapiat (VMAT), kusjuures hüpertermiat rakendati ravikuuri ajal kord nädalas.
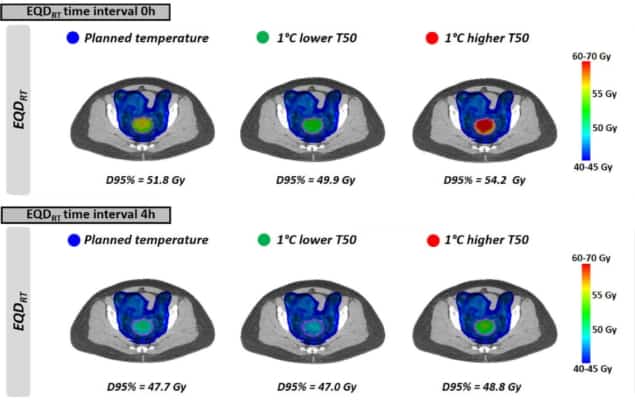
Nagu näha ühtlaste temperatuuride puhul, EQDRT oli väikseima ajaintervalli jaoks suurim. Kui hüpertermiat rakendati vahetult enne või pärast kiiritusravi (ajavahemik 0 h), siis keskmine EQDRT 95% mahust (D95%) oli 51.7 Gy – 6.3 Gy kasv võrreldes ainuüksi kiirgusega. Ajavahemiku suurendamine 4 tunnini vähendas seda võimendust 2.2 Gy-ni.
Mudel ennustas, et suurem osa annuse suurendamisest kaob esimese tunni jooksul. Seetõttu peaks kliinilises kasutuses aeg kiiritusravi ja hüpertermiaga sünnituse vahel olema võimalikult lühike – ideaaljuhul patsientidel, kes saavad mõlemat ravi samas haiglas. Meeskond märgib, et kuigi kahe ravi järjekord ei ole kliiniliselt oluline, kuna kasvaja soojendamine võtab aega, võib hüpertermia esmane rakendamine võimaldada oluliselt lühemaid ajavahemikke, isegi 0 tunni lähedal.
Lõpuks modelleerisid teadlased ravi piiravate kuumade kohtade esinemise tõttu kavandatust veidi madalama kasvaja temperatuuri saavutamise mõju. Mõju EQD-leRT oli kõige tugevam kiiritusravi ja hüpertermia vahelisel lühikesel ajavahemikul. Näiteks 1 °C madalama temperatuuri ja 0-tunnise intervalli korral on keskmine prognoositud EQDRT(D95%) vähenes 1.8 Gy (51.7-lt 49.9 Gy-le); 4-tunnise intervalliga oli langus umbes 0.7 Gy.
Soojenenud kasvajate korral on kiiritusravi efektiivsem
Juhtudel, kui kuumi kohti ei teki, võib olla võimalik suurendada väljundvõimsust ja saavutada kavandatust kõrgem temperatuur. Taaskord oli kõrgema temperatuuri saavutamise kasu suurim lühemate ajavahemike korral, kusjuures täpne võimendus sõltus tegelikest saavutatud temperatuuridest.
"Bioloogiline modelleerimine annab asjakohase ülevaate raviparameetrite ja eeldatava EQD vahelisest seosestRT,” järeldavad Kok ja kolleegid. "EQD maksimeerimiseks on olulised nii kõrged temperatuurid kui ka lühikesed ajavahemikudRT.