ترمورادیوتراپی یک درمان سرطان است که در آن هیپرترمی - گرم کردن تومور تا دمای بالاتر از بدن - برای افزایش اثربخشی رادیوتراپی استفاده می شود. مقدار این افزایش به صورت EQD بیان می شودRTدوز معادل تشعشع مورد نیاز برای دستیابی به همان اثر درمانی بدون گرم کردن.
کارآزماییهای بالینی نشان دادهاند که این رویکرد میتواند به طور قابلتوجهی نتایج درمان را در چندین نوع تومور بدون افزایش سمیت بافت طبیعی بهبود بخشد. مطالعات قبلی همچنین نشان داد که هم دمای بهدستآمده و هم فاصله زمانی بین پرتودرمانی و هایپرترمی بر نتیجه بالینی تأثیر میگذارد.
برای درک این فرآیند با جزئیات بیشتر و کمک به بهینه سازی درمان ها، محققان در آمستردام UMC از مدل سازی بیولوژیکی برای بررسی تاثیر حداکثر دما و فاصله زمانی بر EQD استفاده کرده اندRT. تشریح یافته های خود در مجله بین المللی Radiation Oncology Biology Physicsآنها گزارش می دهند که هم دماهای بالا و هم فواصل زمانی کوتاه برای به حداکثر رساندن بهبود درمانی ضروری هستند.
مدل بیولوژیکی
برای انجام ترمورادیوتراپی، پزشکان از یک دستگاه فرکانس رادیویی یا مایکروویو برای اعمال گرما به تومور یک یا دو بار در هفته، قبل یا بعد از جلسه رادیوتراپی استفاده می کنند. دمای تومور زیر 45 درجه سانتیگراد نگه داشته می شود تا از گرم شدن بافت طبیعی جلوگیری شود، اما گاهی اوقات نقاط داغ ناخواسته (و دردناک) ممکن است رخ دهد که حداکثر سطح توان قابل تحمل را که می توان در طول درمان هایپرترمی استفاده کرد، محدود می کند.
نویسنده اول پترا کوک و همکاران نرم افزاری را برای مدل سازی اثرات بیولوژیکی پرتودرمانی به اضافه هایپرترمی بر حسب توزیع دوز معادل ایجاد کردند. این مدل، که برای مهار ترمیم DNA توسط هایپرترمی، و همچنین سمیت سلولی ناشی از حرارت مستقیم، ارزیابی کیفیت طرحهای درمان ترکیبی را با استفاده از هیستوگرامهای دوز-حجم استاندارد ممکن میسازد.
برای به دست آوردن بینش اولیه در مورد تأثیر پارامترهای هایپرترمی، تیم ابتدا افزایش توزیع دوز استاندارد 23 × 2 گری را توسط دماهای همگن بین 37 تا 43 درجه سانتی گراد، برای فواصل زمانی بین 0 تا 4 ساعت محاسبه کردند.
مدل نشان داد که EQDRT با افزایش دما و کاهش فاصله زمانی به طور قابل توجهی افزایش یافت. به عنوان مثال، برای یک بازه زمانی 1 ساعت، EQD را پیش بینی کردRT افزایش 2-15 گری برای دما از 39 تا 43 درجه سانتی گراد. این یافته ها بر اهمیت دستیابی به بالاترین دمای قابل تحمل تومور برای بهینه سازی نتیجه بالینی تاکید می کند.
تأثیر بازه زمانی در دماهای بالاتر (بالاتر از 41 درجه سانتیگراد) بیشتر مشهود بود. در دمای معمولی هیپرترمیک 41.5 درجه سانتیگراد، یک EQDRT افزایش حدود 10 گری با فاصله زمانی 0 ساعت به دست آمد. این افزایش به حدود 4 گری با فاصله 4 ساعت کاهش یافت، که نشان می دهد با افزایش فاصله زمانی، دمای بالاتری برای تحقق همان اثر مورد نیاز است.
موارد بالینی
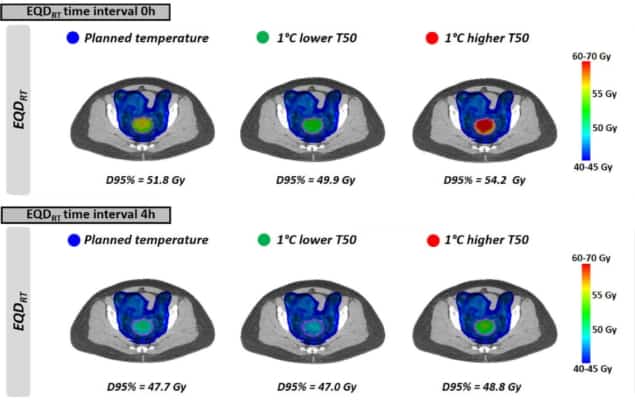
در مرحله بعد، محققان سناریوهای درمانی واقع بینانه را بر اساس توزیع دمایی ناهمگن و برنامه های پرتودرمانی بالینی ارزیابی کردند. آنها EQD را محاسبه کردندRT برای 10 بیمار مبتلا به سرطان دهانه رحم پیشرفته موضعی. همه بیماران 23 × 2 گری قوس درمانی مدوله شده حجمی (VMAT)، با هیپرترمی به صورت هفتگی در طول دوره درمان دریافت کرده بودند.
همانطور که با دمای یکنواخت، EQD دیده می شودRT بزرگترین برای کوچکترین فاصله زمانی بود. هنگامی که هایپرترمی بلافاصله قبل یا بعد از رادیوتراپی (فاصله زمانی 0 ساعت) اعمال شد، میانگین EQDRT تا 95 درصد از حجم (D95٪) 51.7 گری بود - افزایش 6.3 گری تنها نسبت به تابش. افزایش فاصله زمانی به 4 ساعت این افزایش را به 2.2 گری کاهش داد.
مدل پیش بینی کرد که بیشتر افزایش دوز در یک ساعت اول از بین می رود. بنابراین، برای استفاده بالینی، زمان بین رادیوتراپی و زایمان هایپرترمی باید تا حد امکان کوتاه باشد - به طور ایده آل برای بیمارانی که هر دو درمان را در یک بیمارستان دریافت می کنند. این تیم خاطرنشان میکند که اگرچه ترتیب دو درمان از نظر بالینی مرتبط نیست، زیرا گرم کردن تومور به زمان نیاز دارد، استفاده از هیپرترمی ابتدا میتواند فواصل زمانی بسیار کوتاهتری را حتی نزدیک به 0 ساعت ایجاد کند.
در نهایت، محققان تأثیر دستیابی به دمای تومور کمی پایینتر از برنامهریزی شده را به دلیل وقوع نقاط داغ محدودکننده درمان مدلسازی کردند. تاثیر بر EQDRT برای یک فاصله زمانی کوتاه بین رادیوتراپی و هایپرترمی بیشتر مشخص بود. برای 1 درجه سانتی گراد دمای پایین تر و فاصله زمانی 0 ساعت، برای مثال، میانگین پیش بینی شده EQDRT(D95٪) 1.8 گری (از 51.7 به 49.9 گری) کاهش یافت. برای یک بازه زمانی 4 ساعت، کاهش حدود 0.7 گری بود.
رادیوتراپی در تومورهای گرم شده مؤثرتر است
در مواردی که هیچ نقطه داغی ظاهر نمی شود، ممکن است بتوان توان خروجی را افزایش داد و به دمای بالاتر از حد برنامه ریزی شده رسید. بار دیگر، مزیت دستیابی به دمای بالاتر برای فواصل زمانی کوتاهتر، با افزایش دقیق بستگی به دمای واقعی بدست آمده، بیشتر بود.
مدلسازی بیولوژیکی بینش مرتبطی را در مورد رابطه بین پارامترهای درمان و EQD مورد انتظار ارائه میکندRTکوک و همکارانش نتیجه می گیرند. هم دماهای بالا و هم فواصل زمانی کوتاه برای به حداکثر رساندن EQD ضروری هستندRT.