Lämpösädehoito on syövän hoitomuoto, jossa hypertermiaa – kasvaimen kuumenemista kehon lämpötilan yläpuolelle – käytetään sädehoidon tehokkuuden lisäämiseen. Tämän parannuksen määrä ilmaistaan EQD:näRT, vastaava säteilyannos, joka tarvitaan saman terapeuttisen vaikutuksen saavuttamiseen ilman kuumennusta.
Kliiniset tutkimukset ovat osoittaneet, että tämä lähestymistapa voi parantaa merkittävästi hoitotuloksia useissa kasvaintyypeissä lisäämättä normaalia kudostoksisuutta. Aiemmat tutkimukset osoittivat myös, että sekä saavutettu lämpötila että aikaväli sädehoidon ja hypertermian välillä vaikuttavat kliiniseen lopputulokseen.
Ymmärtääkseen tätä prosessia yksityiskohtaisemmin ja auttaakseen hoitojen optimoinnissa, tutkijat osoitteessa Amsterdamin UMC ovat käyttäneet biologista mallintamista tutkiakseen maksimilämpötilan ja aikavälin vaikutusta EQD:henRT. Kuvaavat havaintojaan International Journal of Radiation Oncology Biology PhysicsHe raportoivat, että sekä korkeat lämpötilat että lyhyet aikavälit ovat välttämättömiä terapeuttisen tehokkuuden maksimoimiseksi.
Biologinen malli
Lämpösädehoidon suorittamiseksi kliinikot käyttävät radiotaajuutta tai mikroaaltouunia lämmittääkseen kasvainta kerran tai kahdesti viikossa joko ennen sädehoitoa tai sen jälkeen. Kasvaimen lämpötila pidetään alle 45°C normaalin kudoksen kuumenemisen estämiseksi, mutta joskus voi ilmaantua ei-toivottuja (ja kivuliaita) kuumia kohtia, jotka rajoittavat ylilämpöhoidon aikana käytettävää suurinta siedettävää tehotasoa.
Ensimmäinen kirjoittaja Petra Kok ja kollegat kehittivät ohjelmiston sädehoidon ja hypertermian biologisten vaikutusten mallintamiseksi ekvivalenttien annosjakaumien perusteella. Malli, joka ottaa huomioon hypertermian aiheuttaman DNA-korjauksen eston sekä suoran lämmön aiheuttaman sytotoksisuuden, mahdollistaa yhdistettyjen hoitosuunnitelmien laadun arvioinnin standardiannos-tilavuushistogrammeilla.
Saadakseen peruskäsityksen hypertermiaparametrien vaikutuksesta ryhmä laski ensin standardin 23 × 2 Gy:n annosjakauman paranemisen homogeenisilla lämpötiloilla 37–43 °C välillä 0–4 tuntia.
Malli osoitti, että EQDRT lisääntyi merkittävästi sekä lämpötilan noustessa että aikavälin lyhentyessä. Esimerkiksi 1 tunnin aikavälillä se ennusti EQD:nRT nousu 2–15 Gy lämpötiloissa 39 °C:sta 43 °C:seen. Nämä havainnot korostavat korkeimman siedettävän kasvaimen lämpötilan saavuttamisen tärkeyttä kliinisen lopputuloksen optimoimiseksi.
Aikavälin vaikutus oli voimakkain korkeammissa lämpötiloissa (yli 41°C). Tyypillisessä hypertermisessä lämpötilassa 41.5 °C EQDRT Noin 10 Gy:n lisäys saavutettiin 0 tunnin aikavälillä. Tämä väheni noin 4 Gy:n parantumiseen 4 tunnin välein, mikä osoittaa, että kun aikaväli kasvaa, tarvitaan korkeampaa lämpötilaa saman vaikutuksen toteuttamiseksi.
Kliiniset tapaukset
Seuraavaksi tutkijat arvioivat realistisia hoitoskenaarioita, jotka perustuivat epähomogeenisiin lämpötilajakaumiin ja kliinisiin sädehoitosuunnitelmiin. He laskivat EQD:nRT 10 potilaalle, joilla on paikallisesti edennyt kohdunkaulan syöpä. Kaikki potilaat olivat saaneet 23 × 2 Gy:n volyymimoduloitua kaarihoitoa (VMAT), ja hypertermiaa sovellettiin viikoittain hoitojakson aikana.
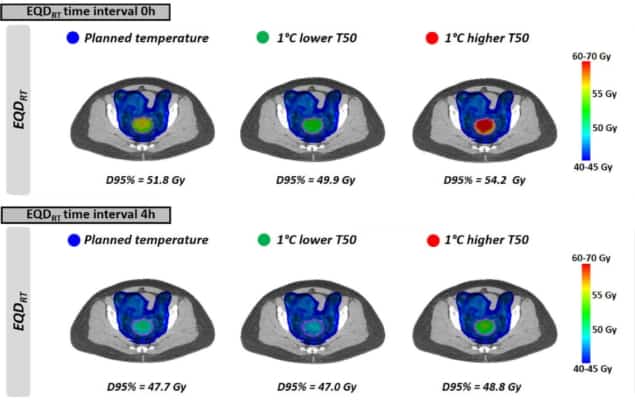
Kuten tasaisista lämpötiloista nähdään, EQDRT oli suurin pienimmällä aikavälillä. Kun hypertermiaa käytettiin välittömästi ennen sädehoitoa tai sen jälkeen (0 tunnin aikaväli), keskimääräinen EQDRT 95 % tilavuudesta (D95 %) oli 51.7 Gy – 6.3 Gy:n lisäys pelkkään säteilyyn verrattuna. Aikavälin pidentäminen 4 tuntiin pienensi tämän vahvistuksen 2.2 Gy:iin.
Malli ennusti, että suurin osa annoksen lisäyksestä menetetään ensimmäisen tunnin aikana. Siksi kliinisessä käytössä sädehoidon ja hypertermian synnytyksen välisen ajan tulisi olla mahdollisimman lyhyt – ihannetapauksessa potilaille, jotka saavat molempia hoitoja samassa sairaalassa. Tutkimusryhmä huomauttaa, että vaikka näiden kahden hoidon järjestys ei ole kliinisesti merkityksellinen, koska kasvaimen lämmittäminen vie aikaa, hypertermian soveltaminen ensin voisi mahdollistaa huomattavasti lyhyemmät aikavälit, jopa lähellä 0 tuntia.
Lopuksi tutkijat mallinsivat vaikutusta hieman suunniteltua alhaisempien kasvainlämpötilojen saavuttamiseen hoitoa rajoittavien kuumapisteiden esiintymisen vuoksi. Vaikutus EQD:henRT oli voimakkain lyhyellä aikavälillä sädehoidon ja hypertermian välillä. Esimerkiksi 1°C alemmalla lämpötilalla ja 0 tunnin aikavälillä keskiarvo ennustettu EQDRT(D95 %) laski 1.8 Gy (51.7 Gy:stä 49.9 Gy:ään); 4 tunnin aikana lasku oli noin 0.7 Gy.
Sädehoito on tehokkaampaa lämmitetyissä kasvaimissa
Tapauksissa, joissa kuumia kohtia ei esiinny, voi olla mahdollista lisätä lähtötehoa ja saavuttaa suunniteltua korkeampi lämpötila. Jälleen kerran korkeamman lämpötilan saavuttamisen hyöty oli suurin lyhyemmillä aikaväleillä, jolloin tarkka vahvistus riippui todellisista saavutetuista lämpötiloista.
"Biologinen mallinnus antaa merkityksellisen käsityksen hoitoparametrien ja odotetun EQD:n välisestä suhteestaRT", Kok ja kollegat päättävät. ”Sekä korkeat lämpötilat että lyhyet aikavälit ovat välttämättömiä EQD:n maksimoimiseksiRT.