Kehomme molekyylikoneisto hajoaa iän myötä.
DNA kerää mutaatioita. Niiden suojaavat päät kuluvat pois. Mitokondriot, solun energiatehdas, horjuvat ja hajoavat. Immuunijärjestelmä menee sekaisin. Kantasolujen varavarasto hupenee, kun taas jotkut kypsät solut siirtyvät zombien kaltaiseen tilaan ja sylkevät myrkyllisiä kemikaaleja ympäristöönsä.
Kuva kuulostaa kamalalta, mutta se ei ole huono uutinen. Ikääntyminen on monimutkainen pulma. Löytämällä yksittäisiä kappaleita tiedemiehet voivat koota täydellisen kuvan siitä, miten ja miksi ikääntymme – ja suunnitella uusia tapoja torjua ikään liittyviä oireita.
Menestystä on jo tullut. Senolytics - lääkkeet, jotka tappavat zombiesolujaovat jo kliinisissä tutkimuksissa. Osittainen uudelleenohjelmointi, joka poistaa solun identiteetin ja palauttaa sen takaisin kantasolun kaltaiseen tilaan, on saamassa höyryä lupaavana vaihtoehtoisena hoitona, ja se on yksi Piilaakson kuumimmista pitkäikäisistä sijoituksista.
Uusi tutkimus in luonto metsästi toisen palan ikääntyvään palapeliin. Viidessä lajissa evoluution mittakaavassa – matoissa, kärpäsissä, hiirissä, rotissa ja ihmisissä – tiimi hioi kriittistä molekyyliprosessia, joka antaa voiman jokaiselle kehon solulle ja hajoaa iän myötä.
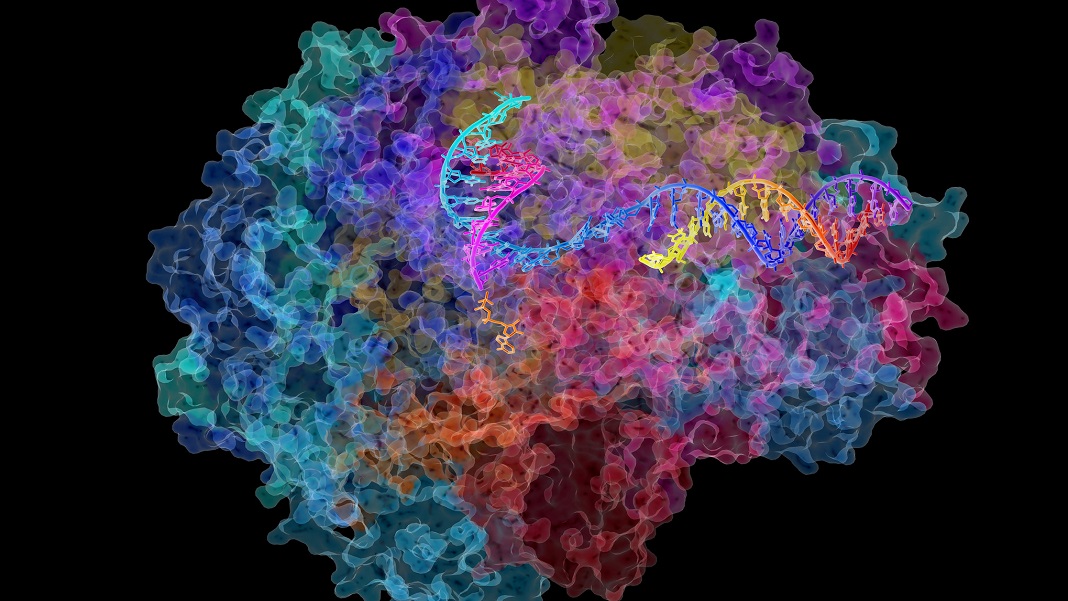
Prosessi, jota kutsutaan transkriptioksi, on ensimmäinen askel geneettisen materiaalimme muuttamisessa proteiineihin. Täällä DNA-kirjaimet työstetään uudelleen "lähettiläksi", jota kutsutaan RNA:ksi, joka sitten siirtää tiedot solun muihin osiin proteiinien valmistamiseksi.
Tiedemiehet ovat pitkään epäilleet, että transkriptio voi mennä pieleen ikääntymisen myötä, mutta uusi tutkimus tarjoaa todisteita siitä, että se ei mene - kierteellä. Kaikissa viidessä testatussa lajissa organismin vanhetessa prosessi nopeutui yllättävän paljon. Mutta kuten yrittää kirjoittaa nopeammin, kun silmät on sidottu, myös virheprosentit nousivat.
Siinä on korjaus. Käyttämällä kahta interventiota, joiden tiedettiin pidentävän elinikää, ryhmä pystyi hidastamaan transkriptiota useissa lajeissa, mukaan lukien hiiret. Geneettiset mutaatiot, jotka kumosivat huolimattoman transkription, pidensivät myös matojen ja hedelmäkärpästen elinikää ja lisäsivät ihmissolujen kykyä jakautua ja kasvaa.
Uusi ikääntymisen tunnusmerkki on tuskin valmis ihmisen testattavaksi. Mutta "se avaa todella perustavanlaatuisen uuden alueen ymmärtää, miten ja miksi ikääntymme", sanoi Tri Lindsay Wu UNSW Sydneystä, joka ei ollut mukana tutkimuksessa.
Geneettinen editori
Geneettisen suunnitelmamme muuttaminen proteiineiksi on kaksivaiheinen prosessi.
Ensinnäkin DNA:n neljä kirjainta – A, T, C ja G – transkriptoidaan RNA:ksi. Myös neljästä kirjaimesta koostuva RNA on pohjimmiltaan molekulaarisia muistiinpanoja, jotka voivat liukua DNA:n suljetun tilan ohi toimittaakseen viestejä solun proteiinia valmistavalle tehtaalle. Siellä RNA käännetään proteiinien kielelle.
Ensimmäinen askel – DNA:n muuttaminen RNA:ksi – on vaikeampi kuin miltä se kuulostaa. Tilan säästämiseksi DNA on tiukasti kääritty proteiiniryhmän, jota kutsutaan histoneiksi, ympärille, kuten pekoni kahdeksan parsan varren ympärille. Tämä "piilottaa" tehokkaasti geneettisen tiedon, mikä tekee solun mahdottomaksi lukea.
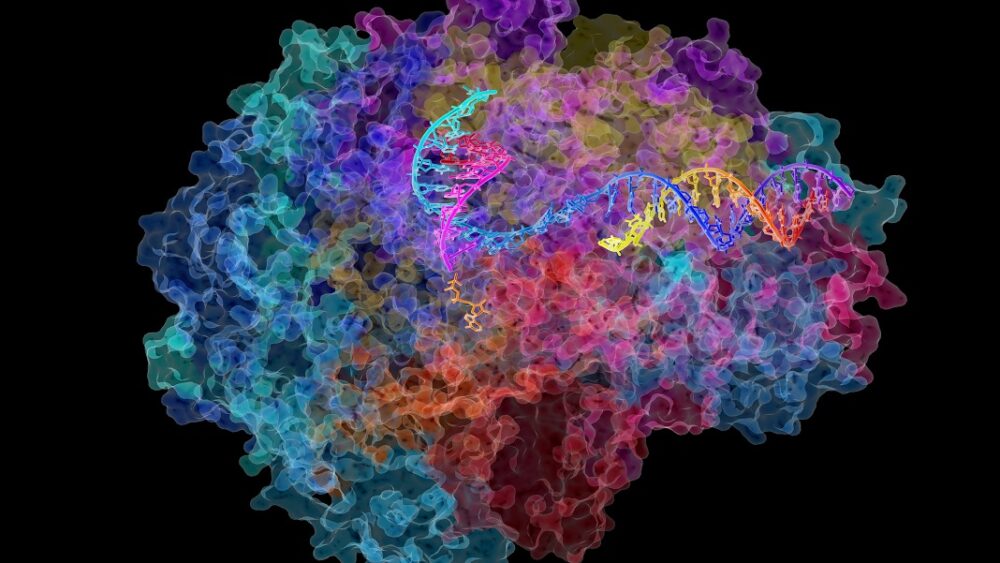
DNA:n purkamiseen ja sen valmistelemiseen transkriptiota varten tarvitaan kokonainen kylä proteiiniauttajia. Mutta tähti on Pol II (RNA-polymeraasi II), jättimäinen monikompleksi, joka liikkuu DNA-säiettä pitkin auttaen sitä muuttumaan RNA:n varhaisversioksi, jota kutsutaan osuvasti pre-RNA:ksi.
Kuten sanallinen lause, pre-RNA kopioidaan sitten pithier-sekvensseihin proteiinien rakentamiseksi, prosessia kutsutaan silmukoitumiseksi. Pol II ohittaa koko prosessin ja varmistaa, että sadat tuhannet RNA:t valmistetaan täydellisesti.
Mutta ikääntyessämme prosessi heikkenee. Kukaan ei ole keksinyt miksi.
Uudessa tutkimuksessa kysyttiin: miksi et hioisi transkriptiosarjan tähtiä?
Virtaavat lajit
Ikääntymisen tunnusmerkkien purkamiseen liittyy kompastuskivi: mahdollinen lyijy voi olla merkityksellinen vain yhdelle lajille.
Uusi tutkimus ratkaisi ongelman suoraan tutkimalla viittä lajia. Käyttämällä tekniikkaa, jota kutsutaan RNA-sekvensoinniksi, he vangisivat Pol II:n nopeuden, kun se rullasi alas madon, hedelmäkärpäsen, hiiren, rotan ja ihmissolujen DNA:ta eri ikäisinä. Ihmisnäytteet vaihtelivat 21-70 vuoden iästä sekä kaksi "kuolematonta" viljeltyä solulinjaa.
Vielä kattavamman kuvan saamiseksi tiimi testasi näytteitä useista elimistä, mukaan lukien aivot, maksa, munuaiset ja veri.
Tulokset tulivat yllätyksenä. Vaikka jokaisella lajilla oli oma Pol II:n "nopeustunniste", suuntaus oli sama: Poll II kiihtyi lajien välillä iän myötä jokaisessa tutkitussa kudoksessa. Tarkalla geenillä tai kudoksella ei ollut väliä. Ikään liittyvä muutos kattoi noin 200 erilaista geeniä useissa lajeissa. Paikallisen muutoksen sijaan Pol II -vauhti näytti olevan yleinen ikääntymisen merkki.
Nopeuden myötä tuli kuitenkin virheitä. Liittäminen, joka muokkaa esi-RNA:ita, vaatii Pol II:n nopeuden olevan Goldilocks-vyöhykkeellä. Nopeuden lisääminen lisää huonojen käännösten riskiä, mikä aiemmissa tutkimuksissa "on yhdistetty ikääntymiseen ja lyhentyneeseen elinikään", kirjoittajat selittivät.
"Pol II:n lisääntyneet nopeudet voivat johtaa useampaan transkriptiovirheeseen, koska Pol II:n oikolukukapasiteetti on kyseenalainen", he sanoivat.
Kellon kääntäminen taaksepäin
Jos Pol II ylikierroksilla edistää ikääntymistä, voimmeko hidastaa sitä – ja vuorostaan torjua ikääntymistä?
Yhdessä testissä tiimi hyödynsi kahta tunnettua hoitoa ikääntymisen hidastamiseksi: insuliinisignaloinnin estämistä ja kalorirajoitusta. Madoissa, kärpäsissä ja hiirissä insuliinin havaitsemisreitin geneettinen häiritseminen hidasti Pol II:n vauhtia. Hiirten laittaminen ruokavaliolle varhaisessa aikuisiässä ja keski-iässä – mutta ei vanhuudessa – napautti myös Pol II:n jarruja.
Toinen testi hioi perimmäistä kysymystä: edistääkö Pol II -kiihtyvyys ikääntymistä? Täällä ryhmä seurasi joukkoa geenimanipuloituja matoja ja hedelmäkärpäsiä, joissa oli mutaatioita, jotka vähentävät niiden Pol II -nopeutta. Verrattuna ei-mutantteihin, molemmat muokatut kannat pidensivät elinikää 10-20 prosenttia.
Kun ryhmä käytti CRISPR-Cas9:ää matojen Pol II -mutaatioiden kumoamiseen, niiden elinikä lyheni ja vastasi villityypin ikäisensä. Näyttää siltä, että Pol II on ikääntymisen syy, selittivät kirjoittajat.
Miksi?
Kaivattuaan syvemmälle transkriptiokoneistoon, tiimi löysi yhden vastauksen. Muista: DNA on kääritty pekoni-parsakimppuihin, jotka tunnetaan tieteellisesti nukleosomeina. Vertaamalla ihmisen napalaskimosoluja ja keuhkosoluja ryhmä havaitsi, että solujen ikääntyessä kimput purkautuvat hitaasti ja hajoavat. Tämä tekee Pol II:n paljon helpommaksi liukua DNA-juosteen poikki, mikä puolestaan laukaisee transkriptionopeuden.
Testaamalla edelleen teoriaansa ryhmä lisäsi geneettisesti kahden tyyppisiä histoniproteiineja - nukleosominipun parsan osan - muodostaakseen lisää nukleosomeja ihmissoluihin petrimaljoissa. Tämä puolestaan loi lisää nopeushäviöitä Pol II:lle ja hidasti sitä.
Se toimi. Soluilla, joissa oli lisää histoniproteiineja, oli vähemmän mahdollisuuksia tulla zombie-vanhenevia soluja. Hedelmäkärpäsissä, jotka ovat suosittu malli pitkäikäisyyden tutkimuksessa, geneettinen säätö antoi niille merkittävän elinkaaren nousun.
Vaikka se on vielä hyvin varhaista, tulokset ovat hyviä uutisia mahdolliselle uuden luokan ikääntymistä ehkäiseville lääkkeille. Pol II:ta on tutkittu laajasti syövän hoidossa, ja useat lääkkeet on jo testattu ja hyväksytty, mikä tarjoaa mahdollisuuden käyttää lääkkeitä uudelleen pitkäikäisyyden tutkimukseen.
"Yhdessä tässä esitetyt tiedot paljastavat ikääntymistä edistävän molekyylimekanismin ja toimivat keinona arvioida solukoneiston tarkkuutta ikääntymisen ja sairauksien aikana", ryhmä sanoi.
Kuva pistetilanne: David Bushnell, Ken Westover ja Roger Kornberg, Stanfordin yliopisto/NIH Image Gallery
- SEO-pohjainen sisällön ja PR-jakelu. Vahvista jo tänään.
- Platoblockchain. Web3 Metaverse Intelligence. Tietoa laajennettu. Pääsy tästä.
- Tulevaisuuden lyöminen Adryenn Ashley. Pääsy tästä.
- Lähde: https://singularityhub.com/2023/04/18/this-longevity-study-across-5-species-found-a-new-pathway-to-reverse-aging/
- :on
- :On
- $ YLÖS
- 10
- 70
- a
- kyky
- pystyy
- kerätä
- poikki
- lisä-
- kehittynyt
- Ages
- Vanheneminen
- Kaikki
- pitkin
- jo
- vaihtoehto
- Vaikka
- ja
- Toinen
- vastaus
- erilleen
- hyväksytty
- OVAT
- ALUE
- noin
- AS
- arvioidessaan
- liittyvä
- At
- Tekijät
- takaisin
- Huono
- Pohjimmiltaan
- BE
- koska
- tulossa
- ollut
- Tukkia
- veri
- elin
- edistää
- Boostatut
- boosteja
- Aivot
- Tauko
- taukoja
- Rakentaminen
- by
- nimeltään
- CAN
- Syöpä
- syöpähoito
- Koko
- Aiheuttaa
- Solut
- haastoi
- mahdollisuus
- muuttaa
- luokka
- Kliininen
- torjumiseksi
- verrattuna
- vertaamalla
- monimutkainen
- kattava
- edistää
- katettu
- luotu
- pisteitä
- kriittinen
- tiedot
- syvempää
- toimittaa
- Ruokavalio
- eri
- hirveä
- Sairaus
- dna
- alas
- ajaa
- Huumeet
- aikana
- Varhainen
- helpompaa
- tehokkaasti
- päättyy
- energia
- insinööri
- enter
- Koko
- ympäristö
- virhe
- virheet
- Jopa
- Joka
- tutkii
- selitti
- laajentaa
- tehdas
- Pudota
- nopeampi
- tarkkuus
- kuviollinen
- löytäminen
- Etunimi
- Korjata
- varten
- muoto
- löytyi
- neljä
- alkaen
- koko
- perus-
- saamassa
- jättiläinen
- Go
- Goes
- suuri
- Ryhmä
- Kasvaa
- Olla
- auttaa
- tätä
- kuumin
- Miten
- Kuitenkin
- HTTPS
- ihmisen
- Sadat
- Identiteetti
- kuva
- Immuunijärjestelmä
- mahdoton
- in
- Mukaan lukien
- lisää
- henkilökohtainen
- tiedot
- Investoinnit
- osallistuva
- IT
- jpg
- Tappaa
- tunnettu
- Kieli
- johtaa
- elinikä
- pitää
- linjat
- Maksa
- paikallinen
- Pitkät
- pitkäikäisyys
- koneet
- tehty
- tehdä
- TEE
- Tekeminen
- merkki
- Hyväksytty
- materiaali
- asia
- kypsä
- Saattaa..
- välineet
- mekanismi
- viestien
- Keskimmäinen
- mitokondriot
- malli
- molekyyli-
- lisää
- liikkuu
- moninkertainen
- luonto
- Uusi
- uutiset
- merkittävä
- Huomautuksia
- romaani
- of
- Tarjoukset
- Vanha
- on
- ONE
- avautuu
- Muut
- meidän
- oma
- Rauha
- osa
- osat
- Ohi
- prosentti
- kuva
- kappale
- kappaletta
- Platon
- Platonin tietotieto
- PlatonData
- äänestys
- pool
- Suosittu
- mahdollinen
- mahdollisesti
- valtuudet
- Valmistella
- esitetty
- edellinen
- Ongelma
- prosessi
- lupaava
- todiste
- suojaava
- Proteiini
- Proteiinit
- tarjoamalla
- Putting
- palapeli
- kysymys
- RAT
- Hinnat
- pikemminkin
- Lue
- valmis
- vähentää
- merkityksellinen
- muistaa
- tutkimus
- Varanto
- rajoitus
- tulokset
- paljastaa
- käänteinen
- Riski
- RNA
- Valssattu
- karkeasti
- Said
- sama
- tutkijat
- näytti
- näyttää
- tuomita
- sekvensointi
- palvella
- näyttää
- Pii
- Silicon Valley
- single
- SLIDE
- hidas
- Hitaasti
- jonkin verran
- Tila
- nopeus
- nopeudet
- Tähti
- Osavaltio
- Höyry
- Varsi
- Kantasoluja
- Vaihe
- Yhä
- kantoja
- opinnot
- tutkimus
- pahennus
- menestys
- yllätys
- sydney
- oireet
- järjestelmä
- vie
- Tapped
- joukkue-
- testi
- Testaus
- että
- -
- tiedot
- heidän
- Niitä
- tuhansia
- tiukasti
- että
- Muuttaa
- hoito
- Trend
- liipaisu
- VUORO
- Kääntyminen
- twist
- tyypit
- lopullinen
- ymmärtäminen
- Yleismaailmallinen
- Rentoutua
- käytetty
- Laakso
- versio
- Näytä
- Kylä
- tavalla
- tunnettu
- joka
- vaikka
- KUKA
- koko
- with
- työskenteli
- mato
- matoja
- kääritty
- wu
- vuotta
- zephyrnet