Kuvittele itseliikkuvien, radioisotoopilla peittämien hiukkasten armeija, jotka ovat 2500–10,000 XNUMX kertaa pölyhiukkasta pienempiä ja jotka kehoon ruiskutettuaan etsivät syöpäkasvaimia ja kiinnittyvät niihin tuhoten ne. Kuulostaako tieteiskirjallisuudesta? Ei niin hiirille, joilla on virtsarakon syöpä.
Espanjalaiset tutkijat raportoivat, että radioaktiivista jodia sisältävillä nanohiukkasilla, jotka liikkuvat reaktiossa urean kanssa, on kyky erottaa syöpäiset virtsarakon kasvaimet terveestä kudoksesta. Nämä "nanobotit" tunkeutuvat kasvaimen ekstrasellulaariseen matriisiin ja kerääntyvät siihen, jolloin radionuklidihoito saavuttaa tarkan tavoitteensa. Tutkimuksessa, joka tehtiin osoitteessa Katalonian biotekniikan instituutti (IBEC) Barcelonassa, hiirillä, jotka saivat yhden annoksen tätä hoitoa, virtsarakon kasvainten koko pieneni 90 % verrattuna hoitamattomiin eläimiin.
Tämä uusi lähestymistapa saattaa jonain päivänä mullistaa virtsarakon syövän hoidon. Virtsarakon syöpä on kymmenenneksi yleisin syöpä maailmassa, ja yli 600,000 2022 uutta tapausta diagnosoitiin vuonna 220,000 ja yli XNUMX XNUMX kuolemaa maailmanlaajuisesti Maailman terveysjärjestön Global Cancer Observatoryn mukaan.
Ei-lihakseen invasiivinen virtsarakon syöpä, jota esiintyy 75 % tapauksista, hoidetaan tällä hetkellä kasvaimen resektiolla, jota seuraa kemoterapia- tai immunoterapialääkkeiden intravesikaalinen injektio rakkoon. Lääkkeiden antaminen on kuitenkin erityisen haastavaa johtuen uroteelin (virtsateiden sisäpuolta vuoraavan kudoksen) alhaisesta läpäisevyydestä, virtsan sisällön täyttymisestä ja sitä seuraavasta lääkkeiden huuhtoutumisesta. Prosessi on myös epämiellyttävä potilaille, koska heidän on käännettävä vartaloaan aika ajoin makuulla, jotta lääkkeet pääsevät virtsarakon seinämän kaikille puolille. Hoidon jälkeen uusiutumisen riski viiden vuoden sisällä on 30–70 %.
Kliinisten tulosten parantamiseksi päätutkija Samuel Sanchez ja kollegat pyrkivät kehittämään innovatiivisia ja tehokkaampia virtsarakon syövän hoitoja ja vähentämään samalla uusiutumista. Lisäksi kerta-annoshoito alentaisi merkittävästi hoidon kustannuksia, mikä vaatii tällä hetkellä 14–XNUMX sairaalahoitoa.
Ryhmä loi nanobotteja mesohuokoisista piidioksidin nanohiukkasista, joiden pinnoilla oli erilaisia toiminnallisia komponentteja. Näitä ovat radioisotoopit PET-visualisointiin tai radionuklidihoitoon sekä proteiiniureaasi, joka reagoi virtsan urean kanssa ja mahdollistaa nanobotin propulsion.
Kirjoittaminen sisään Luonnon nanoteknologiaTutkijat raportoivat, että kun he lisäsivät nanobottien pisaran liuokseen, joka sisälsi 300 mM ureaa, nanobotit osoittivat kuhisevaa liikettä muodostaen aktiivisia ja voimakkaita rintamia ja kolmiulotteisia pyörteitä. Ilman ureaa nanobotit sedimentoituivat yksinkertaisesti lisäyskohdan lähellä.
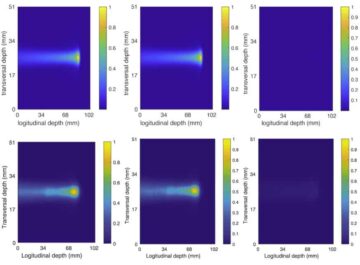
Tutkia, voivatko nanobotit saavuttaa kasvaimen in vivo, tiimi arvioi heidän käyttäytymistään kasvaimia kantavilla hiirillä. Positroniemissiotomografia (PET) -kuvat osoittivat, että radioaktiivisesti leimatuista nanoboteista saadut signaalit sijaitsivat samaan aikaan kasvaimen sijainnin kanssa, kuten MRI:llä määritettiin, ja radioaktiivisuus nähtiin ensisijaisesti kohdekasvainkohdassa. Vain hiirillä, joihin oli injektoitu nanobotteja ja ureaa, kasvainmassassa kertyi huomattavaa määrää – veteen kuljetetut nanobotit ja veteen tai ureaan kuljetetut kontrollinanohiukkaset (ilman ureaasia) osoittivat minimaalisen kasvaimen kertymisen.
Tutkijat ehdottavat, että nanobottien liikkuvuus auttaa niitä tunkeutumaan kasvainmassaan. "Nanoboteista puuttuu spesifisiä vasta-aineita kasvaimen tunnistamiseksi, ja kasvainkudos on tyypillisesti jäykempää kuin terve kudos, mutta näin ei ole virtsarakon kasvaimissa", selittää toinen kirjoittaja Meritxell Serra Casablancas IBEC:stä. "Havaitsimme, että nämä nanorobotit voivat hajottaa kasvaimen solunulkoisen matriisin nostamalla paikallisesti pH:ta itseliikkuvan kemiallisen reaktion avulla. Tämä ilmiö suosi kasvainten lisääntymistä." Tutkijat uskovat, että nanobotit törmäävät uroteeliin kuin se olisi seinä, mutta tunkeutuvat sienimäisempään kasvaimeen.
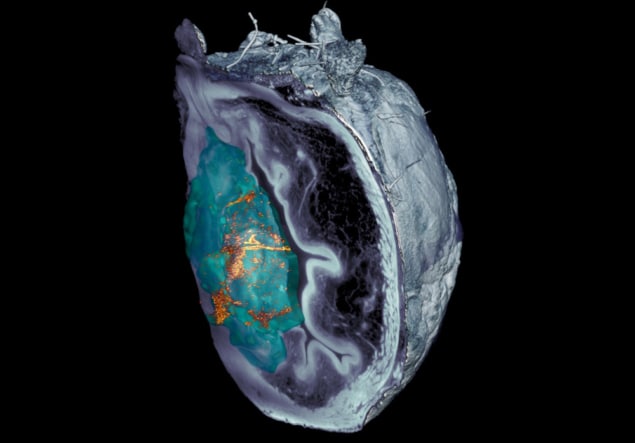
Ryhmä huomauttaa, että nanobottien tunnistaminen leikatun kudoksen mikroskooppikuvista oli haastavaa. Kun konfokaaliset optiset mikroskopiatekniikat epäonnistuivat, tutkijat klo IRB Barcelona kehitti valolevypohjaisen, tasomaiseen laservalaistukseen perustuvan mikroskopiajärjestelmän, joka pystyy skannaamaan virtsarakon eri kerroksia ja luomaan 3D-rekonstruktion koko elimestä.
"Kehittämämme haja-elastinen valolevymikroskopiajärjestelmä antoi meille mahdollisuuden eliminoida itse kasvaimen heijastaman valon, jolloin pystyimme tunnistamaan ja paikantamaan nanopartikkelit kaikkialta elimessä ilman etukäteismerkintää ennennäkemättömällä resoluutiolla", sanoo Julien Colombelli IRB Barcelonasta.

Muokatut bakteerit houkuttelevat syöpää tappavia radioisotooppeja kasvaimiin
Arvioidakseen tekniikan terapeuttista vaikutusta ryhmä merkitsi nanobotit jodi-131:llä (131Minä, radionuklidihoidossa yleisesti käytetty radioisotooppi) ja annoin niitä kasvaimia kantaville hiirille. Hoito menetetyllä annoksella 131I-nanobotit ureassa pysäyttivät kasvaimen kasvun, kun taas suuri annos 131Ureassa annetut I-nanobotit vähensivät kasvaimen tilavuutta lähes 90 % verrattuna hoitamattomiin eläimiin.
Sánchez kertoo Fysiikan maailma että tiimin seuraavat askeleet ovat kapseloida tällä hetkellä kemoterapiassa käytetyt pienet lääkkeet ja jatkaa nanobottien tehokkuuden testaamista lääkkeiden kantajina. Lopulta he aikovat laajentaa nanobottien määrää ja tutkia sääntelypolkuja siirtyäkseen kohti ensimmäisiä kliinisiä tutkimuksia seuraavien kolmen tai neljän vuoden aikana IBEC-spinoffin kautta. Nanobots Therapeutics.
- SEO-pohjainen sisällön ja PR-jakelu. Vahvista jo tänään.
- PlatoData.Network Vertical Generatiivinen Ai. Vahvista itseäsi. Pääsy tästä.
- PlatoAiStream. Web3 Intelligence. Tietoa laajennettu. Pääsy tästä.
- PlatoESG. hiili, CleanTech, energia, ympäristö, Aurinko, Jätehuolto. Pääsy tästä.
- PlatonHealth. Biotekniikan ja kliinisten kokeiden älykkyys. Pääsy tästä.
- Lähde: https://physicsworld.com/a/self-propelling-nanobots-shrink-bladder-tumours-in-mice-by-90/
- :On
- :ei
- $ YLÖS
- 000
- 10
- 135
- 14
- 2022
- 220
- 300
- 3d
- 600
- a
- kyky
- Mukaan
- Tilit
- kerätä
- kertymä
- aktiivinen
- lisä-
- Lisäksi
- Lisäksi
- annettuna
- Jälkeen
- tavoitteena
- Kaikki
- Salliminen
- Myös
- an
- ja
- eläimet
- lähestymistapa
- OVAT
- Armeija
- pidätetty
- AS
- arvioitu
- At
- liittää
- houkutella
- kirjoittaja
- Bakteerit
- Barcelona
- perustua
- käyttäytyminen
- Uskoa
- välillä
- elimet
- elin
- Tauko
- mutta
- by
- CAN
- Syöpä
- kykenee
- harjoittajat
- tapaus
- tapauksissa
- haastava
- kemiallinen
- Kliininen
- kliinisiä tutkimuksia
- työtovereiden
- collide
- KOM
- Yhteinen
- yleisesti
- verrattuna
- osat
- tehty
- pitoisuus
- jatkaa
- ohjaus
- Hinta
- luotu
- Luominen
- Tällä hetkellä
- päivä
- Kuolemat
- toimitettu
- toimitus
- määritetty
- kehittää
- kehitetty
- eri
- erottaa
- annos
- alas
- huume
- Huumeet
- kaksi
- Pöly
- vaikutus
- Tehokas
- tehokkuus
- poistaa
- päästö
- mahdollistaa
- käytössä
- mahdollistaa
- mahdollistaa
- Koko
- EU
- arvioida
- lopulta
- tutkia
- näytteillä
- selittää
- Epäonnistui
- Kaunokirjallisuus
- täyte
- Etunimi
- viisi
- seurannut
- jälkeen
- varten
- neljä
- alkaen
- toiminnallinen
- Global
- Maailmanlaajuisesti
- suurempi
- Kasvu
- HAD
- Olla
- terveys
- terve
- auttaa
- Kuitenkin
- HTTPS
- tunnistaa
- tunnistaminen
- if
- kuvien
- immunoterapia
- parantaa
- in
- sisältää
- lisää
- tiedot
- innovatiivinen
- sisällä
- aikovat
- tulee
- kysymys
- IT
- SEN
- itse
- jpg
- merkinnät
- Lack
- laser
- kerrokset
- Led
- valo
- pitää
- vuori
- paikallisesti
- Matala
- Massa
- Matriisi
- max-width
- Saattaa..
- Mikroskopia
- minimi
- liikkuvuus
- lisää
- eniten
- liike
- liikkua
- MK
- luonto
- Lähellä
- lähes
- Tarve
- Uusi
- seuraava
- huomata
- romaani
- observatorio
- of
- on
- ONE
- vain
- or
- tuloksiin
- yli
- erityisesti
- reittejä
- potilaat
- tunkeutuminen
- ilmiö
- Fysiikka
- Fysiikan maailma
- Platon
- Platonin tietotieto
- PlatonData
- plus
- sijainti
- tarkka
- pääasiallisesti
- Pääasiallinen
- Aikaisempi
- prosessi
- kuljettaa
- työntövoima
- Proteiini
- Hinnat
- tavoittaa
- reaktio
- Reagoi
- vastaanottava
- tunnistaa
- toistuminen
- vähentää
- vähentäminen
- heijastunut
- sääntelyn
- raportti
- Vaatii
- Tutkijat
- päätöslauselma
- mullistaa
- Riski
- sanoo
- Asteikko
- skannaus
- hajallaan
- tiede
- Tieteiskirjallisuus
- Haku
- nähneet
- osoittivat
- Sides
- signaalit
- merkittävästi
- yksinkertaisesti
- single
- paikka
- SIX
- Koko
- pieni
- pienempiä
- So
- ratkaisu
- äänet
- Espanja
- erityinen
- Askeleet
- tutkimus
- myöhempi
- merkittävä
- ehdottaa
- järjestelmä
- Kohde
- joukkue-
- tekniikat
- kertoo
- testi
- kuin
- että
- -
- maailma
- heidän
- Niitä
- itse
- hoito
- Nämä
- ne
- tätä
- kolmella
- kolmiulotteinen
- Kautta
- kauttaaltaan
- thumbnail
- kertaa
- että
- kohti
- käsitelty
- hoito
- hoidot
- tutkimuksissa
- totta
- VUORO
- tyypillisesti
- ennennäkemätön
- päälle
- ottaminen
- us
- käytetty
- eri
- kautta
- visualisointi
- tilavuus
- Seinä
- oli
- vesi
- we
- olivat
- kun
- onko
- joka
- vaikka
- with
- sisällä
- ilman
- maailman-
- olisi
- vuotta
- zephyrnet