Le traitement du cancer par radiothérapie peut stimuler la réponse immunitaire de l'organisme et inhiber la croissance tumorale, mais il peut également réduire le niveau de lymphocytes, les globules blancs associés à la réponse immunitaire, entraînant un contrôle altéré de la tumeur et un mauvais pronostic. La gravité de cette lymphopénie radio-induite est en corrélation avec la dose délivrée aux cellules sanguines et aux lymphocytes circulants. Ainsi, minimiser la dose au cœur, au sang périphérique et aux organes lymphoïdes pourrait contribuer à réduire cet effet néfaste.
Pour approfondir cette théorie, Antje Galts et Abdelkhalek Hammi de l'Université TU Dortmund a étudié si la radiothérapie FLASH – un rayonnement délivré à des débits de dose ultra élevés – pouvait réduire le niveau d'épuisement des cellules immunitaires pendant la protonthérapie chez les patients atteints d'un cancer du cerveau.
« Le mécanisme biologique derrière l’effet d’épargne FLASH observé à des débits de dose élevés n’est pas encore entièrement compris. Cependant, l’une des théories proposées est l’hypothèse immunitaire, qui suggère que l’administration instantanée d’une dose d’irradiation FLASH réduit considérablement la déplétion des lymphocytes circulants en minimisant le temps d’exposition », explique Hammi. "Dans notre étude, nous avons montré qu'un traitement hypofractionné et une administration rapide de la dose épargnaient les cellules immunitaires jusqu'à 27 fois par rapport à un plan de traitement conventionnel fractionné par balayage par faisceau de protons."
Galts et Hammi ont utilisé un modèle dosimétrique de flux sanguin pour simuler la dose reçue par les lymphocytes circulants lors d'une protonthérapie conventionnelle et basée sur FLASH à modulation d'intensité (IMPT) d'une tumeur cérébrale. Le modèle d'administration de faisceau dynamique simule un plan de traitement fractionné IMPT tout en considérant la variation spatio-temporelle du débit de dose de chaque faisceau crayon de protons. Hammi note que le modèle intègre des paramètres de livraison réalistes provenant de cyclotrons disponibles dans le commerce.
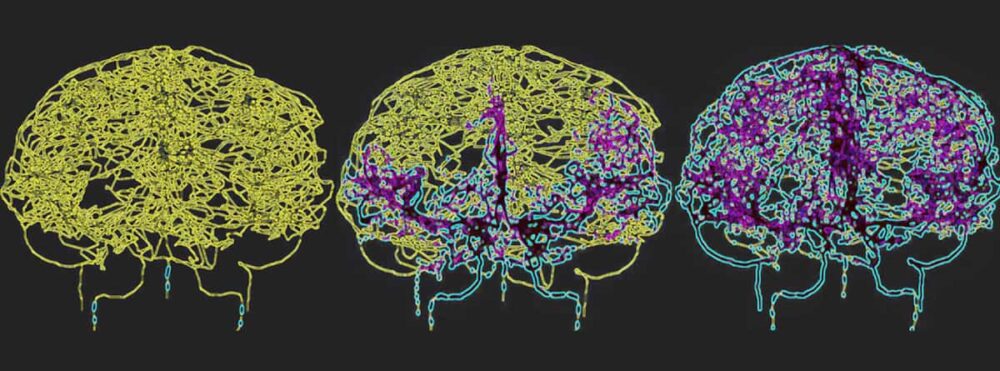
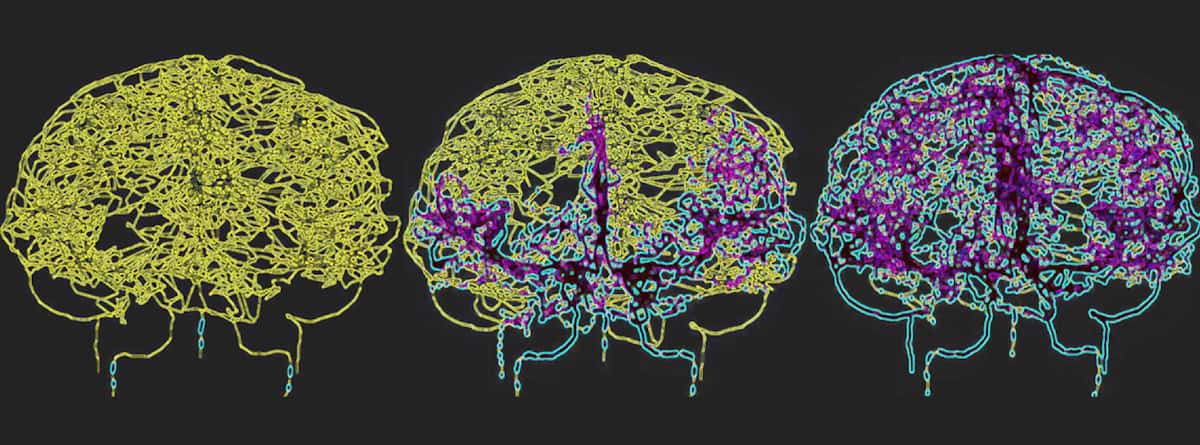
Pour refléter avec précision la circulation sanguine dans le cerveau humain, Galts et Hammi ont cartographié les vaisseaux sanguins directement à partir d'images d'angiographie IRM cérébrale. Ils ont utilisé le modèle vasculaire cérébral résultant, qui comprenait 465 vaisseaux sanguins et 8841 XNUMX branches de vaisseaux individuels, pour simuler la circulation des cellules immunitaires dans la circulation sanguine.
Les chercheurs ont créé des plans de traitement IMPT réalistes pour une tumeur de glioblastome, en utilisant quatre faisceaux de protons incidents et des paramètres d'administration cliniquement pertinents. Ils ont ensuite calculé les champs de rayonnement variables dans le temps auxquels le sang circulant est exposé pendant l'administration des plans de protonthérapie et la dose accumulée après le traitement, rapportant leurs résultats dans Physique en médecine et biologie.
Le glioblastome est la forme de cancer du cerveau la plus mortelle et son traitement par radiothérapie peut provoquer une lymphopénie radio-induite prolongée. "En modélisant un système cérébrovasculaire pendant l'administration de radiations, nous espérons mieux comprendre comment la radiothérapie affecte la réponse immunitaire de ces groupes de patients, ce qui pourrait conduire à de meilleures stratégies thérapeutiques", explique Hammi.
Comparaisons de forfaits
Galts et Hammi ont examiné quatre scénarios de traitement : IMPT FLASH avec une seule fraction de 22.3 Gy ; FLASH hypofractionné utilisant deux fractions de 14.6 Gy et cinq fractions de 8 Gy ; et IMPT conventionnel utilisant trente-deux fractions de 2 Gy. Pour chaque plan de traitement, ils ont évalué l’impact dosimétrique sur les lymphocytes circulants et estimé la radiotoxicité qui en résulte.
Les histogrammes dose-volume ont révélé que la radiothérapie FLASH réduisait considérablement la proportion de cellules irradiées par rapport au débit de dose conventionnel IMPT. Au cours de la première fraction de traitement, les trois programmes FLASH ont irradié environ 1.52 % du volume sanguin circulant, tandis que l'IMPT conventionnel en a irradié 2.18 %. Les plans FLASH hypofractionnés, délivrés en deux ou cinq fractions, ont augmenté ce volume irradié à 3.01 % et 7.35 %, respectivement, tandis que l'IMPT conventionnel exposait 42.41 % du sang périphérique aux radiations.
Ensuite, les chercheurs ont examiné le niveau de lymphocytes circulants ayant reçu une dose d’au moins 7 cGy – un seuil qui provoque une déplétion de 2 % de la population lymphocytaire – pendant toute la durée du traitement. Après avoir terminé l'IMPT conventionnel, 25.65 % des lymphocytes circulants ont reçu une dose d'au moins 7 cGy. Pour les traitements FLASH à une, deux et cinq fractions, les volumes recevant plus que ce seuil de dose étaient respectivement de 1.21 %, 2.30 % et 5.14 %.
Les volumes de lymphocytes circulants recevant des doses supérieures à 100 cGy, provoquant une déplétion de 30 %, étaient respectivement de 0.77 %, 1.28 % et 2.09 % pour le FLASH à une, deux et cinq fractions, et 0.10 % au cours de l'IMPT conventionnel.
Galts et Hammi ont également étudié la réponse des lymphocytes CD4+ et CD8+, qui ont des distributions différentes dans le sang périphérique, aux différents scénarios d'irradiation. Pour les deux types de lymphocytes, la destruction cellulaire après la première fraction était respectivement de 0.66 %, 0.62 %, 0.32 % et 0.08 % pour le FLASH à une, deux et cinq fractions et l'IMPT conventionnel.
Un modèle informatique détermine la dose au sang pendant la radiothérapie
Après le traitement complet, la déplétion en lymphocytes était respectivement de 1.02 % et 1.56 % pour les fractions de deux et cinq traitements, et de 2.14 % pour l'IMPT conventionnel. Ces résultats démontrent que la protonthérapie FLASH épargne les cellules immunitaires circulantes pendant le traitement intracrânien, le FLASH en fraction unique réduisant le taux d'épuisement de près de 70 % par rapport à l'IMPT conventionnel.
Hammi raconte Monde de la physique qu'ils étendent désormais le modèle pour inclure les cancers de la tête et du cou. "En outre, nous explorons diverses méthodes d'administration de FLASH et leur impact sur l'épuisement du système immunitaire, avec un accent particulier sur le traitement FLASH conformiste basé sur une modulation d'énergie passive spécifique au patient", explique-t-il. « Ce modèle d’administration a le potentiel d’épargner davantage de lymphocytes en circulation par rapport à l’administration FLASH par diffusion. »
- Contenu propulsé par le référencement et distribution de relations publiques. Soyez amplifié aujourd'hui.
- PlatoData.Network Ai générative verticale. Autonomisez-vous. Accéder ici.
- PlatoAiStream. Intelligence Web3. Connaissance Amplifiée. Accéder ici.
- PlatonESG. Carbone, Technologie propre, Énergie, Environnement, Solaire, La gestion des déchets. Accéder ici.
- PlatoHealth. Veille biotechnologique et essais cliniques. Accéder ici.
- La source: https://physicsworld.com/a/flash-irradiation-spares-immune-cells-during-proton-therapy/
- :possède
- :est
- :ne pas
- $UP
- 1
- 10
- 100
- 14
- 160
- 2%
- 22
- 25
- 27
- 35%
- 7
- 8
- a
- Accumulé
- avec précision
- Après
- Tous
- presque
- aussi
- an
- ainsi que le
- SONT
- autour
- AS
- évalué
- associé
- At
- disponibles
- basé
- Faisceau
- derrière
- sang
- tous les deux
- Cerveau
- cancer du cerveau
- branches
- mais
- by
- calculé
- CAN
- Cancer
- Causes
- les causes
- cellule
- Cellules
- circulé
- La circulation
- cliquez
- commercialement
- par rapport
- compléter
- considérant
- des bactéries
- conventionnel
- pourriez
- créée
- profond
- livré
- page de livraison.
- démontrer
- détermine
- différent
- directement
- distribution
- distributions
- dose
- doses
- pendant
- Dynamic
- chacun
- effet
- énergie
- Tout
- égal
- Équilibre
- estimé
- expansion
- Explique
- Exploré
- Explorer
- exposé
- Exposition
- RAPIDE
- Des champs
- résultats
- Prénom
- cinq
- Flash
- flux
- Focus
- Abonnement
- Pour
- formulaire
- quatre
- fraction
- De
- plein
- d’étiquettes électroniques entièrement
- plus
- Gain
- Groupes
- Croissance
- Vous avez
- he
- Cœur
- vous aider
- Haute
- d'espérance
- Comment
- Cependant
- HTTPS
- humain
- image
- satellite
- Système immunitaire
- Impact
- amélioré
- IMPT
- in
- incident
- comprendre
- inclus
- incorpore
- increased
- individuel
- d'information
- idées.
- développement
- enquêter
- aide
- IT
- jpg
- meurtre
- conduisant
- au
- à gauche
- Niveau
- plus long
- largeur maximale
- mécanisme
- médecine
- méthodes
- réduisant au minimum
- modèle
- modélisation statistique
- la modélisation
- PLUS
- (en fait, presque toutes)
- mr
- Notes
- maintenant
- of
- on
- ONE
- ouvert
- or
- nos
- ande
- plus de
- paramètres
- particulier
- passif
- patients
- Physique
- Monde de la physique
- plan
- plans
- Platon
- Intelligence des données Platon
- PlatonDonnées
- pauvres
- population
- défaillances
- l'éventualité
- proportion
- proposé
- Radiothérapie
- Tarif
- Tarifs
- réaliste
- reçu
- recevoir
- réduire
- Prix Réduit
- réduit
- réduire
- refléter
- pertinent
- Rapports
- chercheurs
- respectivement
- réponse
- résultant
- Révélé
- bon
- s
- dit
- balayage
- scénarios
- Schémas
- montré
- de façon significative
- unique
- Commencer
- stimuler
- les stratégies
- courant
- étudié
- Étude
- tel
- Suggère
- combustion propre
- raconte
- que
- qui
- Les
- leur
- puis
- théorie
- thérapie
- Ces
- l'ont
- this
- trois
- порог
- Avec
- thumbnail
- fiable
- fois
- à
- traitement
- traitement
- traitements
- oui
- deux
- types
- compris
- université
- d'utiliser
- en utilisant
- divers
- Navire
- le volume
- volumes
- était
- we
- ont été
- quand
- que
- qui
- tout en
- blanc
- comprenant
- dans les
- world
- encore
- zéphyrnet