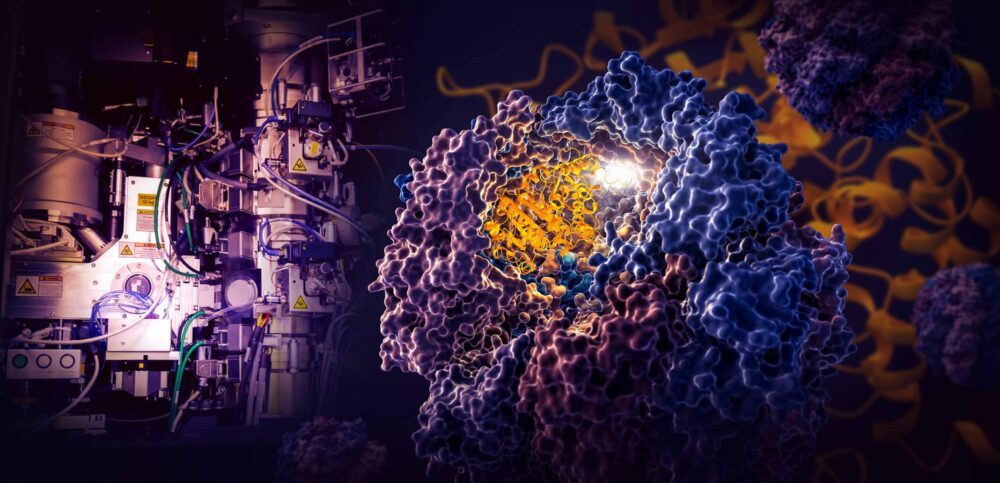
Une étude historique menée par des chercheurs du Laboratoire national des accélérateurs SLAC du Département de l'énergie et de l'Université de Stanford révèle comment une minuscule machine cellulaire appelée TRiC dirige le repliement de la tubuline, une protéine humaine qui est la pierre angulaire des microtubules qui servent d'échafaudage et de système de transport à la cellule. .
Jusqu'à présent, les scientifiques pensaient que TRiC et des machines similaires, appelées chaperonines, fournissaient passivement un environnement propice au repliement, mais n'y participaient pas directement.
Selon les chercheurs, jusqu'à 10% des protéines de nos cellules, ainsi que celles des plantes et des animaux, reçoivent une aide pratique de ces petites chambres pour se replier dans leurs formes actives finales.
De nombreuses protéines qui se replient à l'aide de TRiC sont intimement liées à des maladies humaines, y compris certains cancers et troubles neurodégénératifs comme les maladies de Parkinson, de Huntington et d'Alzheimer, a déclaré le professeur de Stanford Judith Frydman, l'un des principaux auteurs de l'étude.
En fait, dit-elle, de nombreux médicaments anticancéreux sont conçus pour perturber la tubuline et les microtubules qu'elle forme, qui sont vraiment importants pour la division cellulaire. Ainsi, cibler le processus de repliement de la tubuline assisté par TRiC pourrait fournir une stratégie anti-cancer attrayante.
L'équipe a rapporté les résultats de leur étude d'une décennie dans un article publié dans Cellule dès aujourd’hui.
"C'est la structure protéique la plus excitante sur laquelle j'ai travaillé au cours de mes 40 ans de carrière", a déclaré le professeur Wah Chiu du SLAC/Stanford, pionnier dans le développement et l'utilisation de la microscopie électronique cryogénique (cryo-EM) et directeur de la division cryo-EM et bioimagerie du SLAC.
"Quand j'ai rencontré Judith il y a 20 ans," il a dit, « Nous avons discuté de la possibilité de voir les protéines se replier. C'est quelque chose que les gens essaient de faire depuis des années, et maintenant nous l'avons fait.
Les chercheurs ont capturé quatre étapes distinctes du processus de repliement dirigé par TRiC à une résolution quasi atomique avec cryo-EM, et ont confirmé ce qu'ils ont vu avec des analyses biochimiques et biophysiques.
Au niveau le plus élémentaire, a déclaré Frydman, cette étude résout l'énigme de longue date de la raison pour laquelle la tubuline ne peut pas se replier sans l'aide de TRiC : "Cela change vraiment la donne en apportant enfin une nouvelle façon de comprendre comment les protéines se replient dans la cellule humaine."
Plier les spaghettis en fleurs
Les protéines jouent un rôle essentiel dans pratiquement tout ce que fait une cellule, et découvrir comment elles se replient dans leurs états 3D finaux est l'une des quêtes les plus importantes en chimie et biologie.
Comme le dit Chiu, "Une protéine commence par une chaîne d'acides aminés qui ressemble à des spaghettis, mais elle ne peut pas fonctionner tant qu'elle n'est pas pliée en une fleur de la bonne forme."
Depuis le milieu des années 1950, notre image de la façon dont les protéines se replient a été façonnée par des expériences réalisées à l'aide de petites protéines par Christian Anfinsen, chercheur aux National Institutes of Health. Il a découvert que s'il dépliait une petite protéine, elle reprendrait spontanément la même forme et a conclu que les instructions pour le faire étaient codées dans la séquence d'acides aminés de la protéine. Anfinsen a partagé le prix Nobel 1972 en chimie pour cette découverte.
Trente ans plus tard, des chercheurs ont découvert que des machines cellulaires spécialisées aidaient les protéines à se replier. Mais l'opinion dominante était que leur fonction se limitait à aider les protéines à effectuer leur repliement spontané en les protégeant contre le piégeage ou la fusion.
Un type de machine auxiliaire, appelée chaperonine, contient une chambre en forme de tonneau qui contient des protéines à l'intérieur pendant qu'elles se replient. TRiC entre dans cette catégorie.
La chambre TRiC est unique en ce qu'elle se compose de huit sous-unités différentes qui forment deux anneaux empilés. Un long brin mince de protéine de tubuline est délivré dans l'ouverture de la chambre par une molécule auxiliaire en forme de méduse. Ensuite, le couvercle de la chambre se ferme et le pliage commence. Quand c'est fait, le couvercle s'ouvre et la tubuline finie et pliée part.
Étant donné que la tubuline ne peut pas se replier sans TRiC, il est apparu que TRiC pouvait faire plus qu'aider passivement la tubuline à se replier spontanément. Mais comment ça marche exactement ? Cette nouvelle étude répond à cette question et démontre que, du moins pour des protéines comme la tubuline, le concept de « repliement spontané » ne s'applique pas. Au lieu de cela, TRiC orchestre directement la voie de repliement menant à la protéine correctement formée.
Bien que les progrès récents de l'intelligence artificielle, ou IA, puissent prédire la structure finie et pliée de la plupart des protéines, a déclaré Frydman, l'IA ne montre pas comment une protéine atteint sa forme correcte. Cette connaissance est fondamentale pour contrôler le repliement dans la cellule et développer des thérapies pour les maladies du repliement. Pour atteindre cet objectif, les chercheurs doivent comprendre les étapes détaillées du processus de repliement tel qu'il se produit dans la cellule.
Une chambre cellulaire prend en charge
Il y a dix ans, Frydman, Chiu et leurs équipes de recherche ont décidé d'approfondir ce qui se passe dans la chambre TRIC.
"Comparé aux chambres de pliage plus simples des chaperonines dans les bactéries, le TRiC dans les cellules humaines est une machine très intéressante et compliquée", dit Fridman. "Chacune de ses huit sous-unités a des propriétés différentes et présente une surface distincte à l'intérieur de la chambre, ce qui s'avère vraiment important."
Les scientifiques ont découvert que l'intérieur de cette chambre unique dirige le processus de pliage de deux manières.

(Yanyan Zhao/Université de Stanford)
Lorsque le couvercle de la chambre se referme sur une protéine, des zones de charge électrostatique apparaissent sur ses parois internes. Ils attirent les parties chargées de manière opposée du brin de protéine de tubuline et les collent essentiellement au mur pour créer la forme et la configuration appropriées pour la prochaine étape du pliage. Pendant ce temps, les «queues» de la sous-unité TRiC qui pendent de la paroi de la chambre attrapent la protéine de tubuline à des moments et à des endroits spécifiques pour l'ancrer et la stabiliser.
Pour commencer, une extrémité du brin de tubuline s'accroche dans une petite poche dans le mur et se plie. Ensuite, l'autre extrémité se fixe à un endroit différent, créant une grande boucle. La boucle se plie d'une manière qui l'amène juste à côté de la première zone pliée.
À la troisième étape, une partie de la section médiane se replie pour former le noyau de la protéine, ainsi que des poches où le GTP, une molécule qui stocke et libère de l'énergie pour alimenter le travail de la cellule, peut se brancher.
Enfin, la section de protéine restante se replie. La molécule de tubuline est maintenant prête à l'action.
"Ces instantanés structurels des étapes intermédiaires de la séquence de repliement n'ont jamais été vus auparavant par cryo-microscopie électronique", dit Fridman.
Un puissant mélange de techniques
Son équipe a confirmé la séquence de pliage avec une série difficile de tests biochimiques et biophysiques qui ont nécessité des années de travail.
L'interprétation de ces résultats a permis aux chercheurs de construire une image de la forme changeante de la tubuline lorsqu'elle se replie à l'intérieur de la chambre TRiC, ce qui correspond aux images générées par cryo-EM.
"C'est très puissant de pouvoir aller et venir entre ces techniques, car alors vous pouvez vraiment savoir que ce que vous voyez reflète ce qui se passe dans la cellule", dit Fridman.
"La science nous a surpris avec une solution vraiment intéressante que je n'aurais pas prédite."
L'étude offre également des indices pour comprendre comment ce système de repliement a évolué dans les cellules eucaryotes, qui composent les plantes, les animaux et les humains, mais pas dans des cellules plus simples comme celles des bactéries et des archées. Alors que les protéines devenaient de plus en plus complexes pour répondre aux besoins des cellules eucaryotes, les chercheurs suggèrent qu'à un moment donné, elles ne pouvaient pas se plier aux formes dont elles avaient besoin pour effectuer des tâches plus compliquées sans un peu d'aide. Les protéines eucaryotes et leur chambre chaperonine ont probablement évolué ensemble, en commençant peut-être par le dernier ancêtre commun de tous les organismes eucaryotes il y a environ 2.7 milliards d'années.
En raison de la complexité des analyses et de l'intermède pandémique, l'étude a duré si longtemps que bon nombre des personnes qui y ont travaillé ont changé d'emploi. Ils comprennent les chercheurs postdoctoraux Daniel Gestaut et Miranda Collier du groupe de Frydman, qui ont réalisé la partie biochimique du projet et l'ont fait avancer, et Yanyan Zhao, Soung-Hun Roh, Boxue Ma et Greg Pintilie du groupe de Chiu, qui ont effectué la cryo -Analyses EM. Parmi les autres contributeurs figuraient Junsun Park, un étudiant du groupe de Roh, et Alexander Leitner de l'ETH de Zurich, en Suisse.
Le travail a été soutenu par des subventions à Wah Chiu et Judith Frydman du NIH et des subventions à Soung-Hun Roh, qui est maintenant professeur adjoint à l'Université nationale de Séoul, de la Fondation nationale coréenne pour la recherche et de la Fondation Suh Kyungbae (SUHF).
Référence du journal
- Daniel Gestaut et al., Visualisation structurale de la voie de repliement de la tubuline dirigée par la chaperonine humaine TRiC/CCT. Cellule, 8 décembre 2022 DOI : 10.1016 / j.cell.2022.11.014