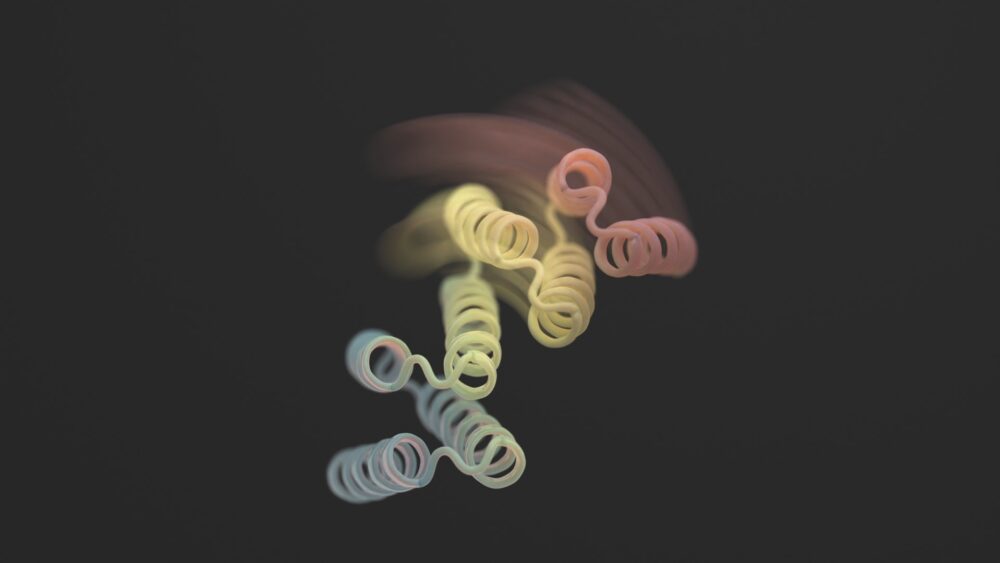
Nous considérons souvent les protéines comme des sculptures 3D immuables.
Ce n'est pas tout à fait juste. De nombreuses protéines sont des transformateurs qui se tordent et changent de forme en fonction des besoins biologiques. Une configuration peut propager des signaux dommageables provenant d’un accident vasculaire cérébral ou d’une crise cardiaque. Un autre peut bloquer la cascade moléculaire qui en résulte et limiter les dommages.
D'une certaine manière, les protéines agissent comme des transistors biologiques : des interrupteurs marche-arrêt à la base de « l'ordinateur » moléculaire du corps qui déterminent la manière dont il réagit aux forces et réactions externes et internes. Les scientifiques étudient depuis longtemps ces protéines qui changent de forme pour déchiffrer le fonctionnement de notre corps.
Mais pourquoi s’appuyer uniquement sur la nature ? Pouvons-nous créer à partir de zéro des « transistors » biologiques inconnus de l’univers biologique ?
Entrez dans l'IA. Plusieurs méthodes d’apprentissage profond peuvent déjà prédire avec précision les structures des protéines :une avancée majeure en préparation depuis un demi-siècle. Des études ultérieures utilisant des algorithmes de plus en plus puissants ont halluciné des structures protéiques non liées aux forces de l’évolution.
Pourtant, ces structures générées par l'IA ont un inconvénient : bien que très complexes, la plupart sont complètement statiques, essentiellement une sorte de sculpture protéique numérique figée dans le temps.
Une nouvelle étude in Sciences ce mois-ci, nous avons brisé le moule en ajoutant de la flexibilité aux protéines de synthèse. Les nouvelles structures ne sont pas des contorsionnistes sans limites. Cependant, les protéines de conception peuvent se stabiliser sous deux formes différentes – pensez à une charnière dans une configuration ouverte ou fermée – en fonction d’un « verrou » biologique externe. Chaque état est analogue au « 0 » ou au « 1 » d'un ordinateur qui contrôle ensuite la sortie de la cellule.
"Avant, nous ne pouvions créer que des protéines ayant une configuration stable", a déclaré l'auteur de l'étude, le Dr Florian Praetorius de l'Université de Washington. « Maintenant, nous pouvons enfin créer des protéines qui bougent, ce qui devrait ouvrir une gamme extraordinaire d’applications. »
L'auteur principal, le Dr David Baker, a des idées : "De la formation de nanostructures qui réagissent aux produits chimiques présents dans l'environnement aux applications dans l'administration de médicaments, nous commençons tout juste à exploiter leur potentiel."
Un mariage de protéines réalisé en IA
Un petit peu de biologie 101.
Les protéines construisent et font fonctionner notre corps. Ces macromolécules commencent leur voyage à partir de l'ADN. L’information génétique est traduite en acides aminés, les éléments constitutifs d’une protéine – des perles illustrées sur un fil. Chaque corde est ensuite pliée en formes 3D complexes, certaines parties collant à d’autres. Appelées structures secondaires, certaines configurations ressemblent à des Twizzlers. D’autres se tissent en draps semblables à des tapis. Ces formes s’appuient les unes sur les autres, formant des architectures protéiques hautement sophistiquées.
En comprenant comment les protéines prennent leur forme, nous pouvons potentiellement en créer de nouvelles à partir de zéro, élargissant ainsi l’univers biologique et créant de nouvelles armes contre les infections virales et d’autres maladies.
En 2020, AlphaFold de DeepMind et RoseTTAFold du laboratoire David Baker ont brisé l'Internet de la biologie structurale en prédisant avec précision les structures des protéines en se basant uniquement sur leurs séquences d'acides aminés.
Depuis lors, les modèles d'IA ont prédit la forme de presque toutes les protéines connues et inconnues de la science. Ces outils puissants remodèlent déjà la recherche biologique, aidant les scientifiques à identifier rapidement des cibles potentielles pour combattre la résistance aux antibiotiques, étudier le « logement » de notre ADN, développer de nouveaux vaccins ou encore faire la lumière sur des maladies qui ravagent le cerveau, comme Maladie de Parkinson.
Puis vint une bombe : les modèles d'IA générative, tels que DALL-E et ChatGPT, offraient une perspective alléchante. Plutôt que de simplement prédire les structures des protéines, pourquoi ne pas faire rêver l'IA complètement nouveau des structures protéiques à la place ? D'une protéine qui lie les hormones pour réguler les niveaux de calcium à enzymes artificielles qui catalysent la bioluminescence, les premiers résultats ont suscité l’enthousiasme et le potentiel des protéines conçues par l’IA semblait infini.
À la tête de ces découvertes se trouve le laboratoire de Baker. Peu de temps après la sortie de RoseTTAFold, ils ont développé un algorithme permettant de localiser les sites fonctionnels d'une protéine, là où elle interagit avec d'autres protéines, médicaments ou anticorps, ouvrant ainsi la voie aux scientifiques. imaginer de nouveaux médicaments qu'ils n'ont pas encore imaginés.
Pourtant, il manquait une chose : la flexibilité. Un grand nombre de protéines « changent de code » de forme pour modifier leur message biologique. Le résultat pourrait littéralement être la vie ou la mort : une protéine appelée Bax, par exemple, modifie sa forme dans une conformation qui déclenche la mort cellulaire. La bêta-amyloïde, une protéine impliquée dans la maladie d'Alzheimer, prend notoirement une forme différente car elle endommage les cellules du cerveau.
Une IA qui hallucine des protéines flip-flop similaires pourrait nous rapprocher de la compréhension et de la récapitulation de ces énigmes biologiques, conduisant ainsi à de nouvelles solutions médicales.
Charnière, ligne et plomb
Concevoir une protéine au niveau atomique – et espérer qu’elle fonctionne dans une cellule vivante – est difficile. En concevoir un avec deux configurations est un cauchemar.
Comme analogie vague, pensez aux cristaux de glace dans un nuage qui finissent par se transformer en flocons de neige, chacun ayant une structure différente. Le travail de l’IA consiste à fabriquer des protéines qui peuvent se déplacer entre deux « flocons de neige » différents en utilisant les mêmes « cristaux de glace » d’acides aminés, chaque état correspondant à un interrupteur « marche » ou « arrêt ». De plus, la protéine doit bien fonctionner à l’intérieur des cellules vivantes.
L'équipe a commencé avec plusieurs règles. Premièrement, chaque structure devrait être très différente entre les deux états, comme un profil humain debout ou assis. Ils pourraient le vérifier en mesurant les distances entre les atomes, a expliqué l'équipe. Deuxièmement, le changement doit se produire rapidement. Cela signifie que la protéine ne peut pas se déployer complètement avant de se reconstituer sous une autre forme, ce qui prend du temps.
Ensuite, il y a quelques lignes directrices pour une protéine fonctionnelle : elle doit bien fonctionner avec les liquides corporels dans les deux états. Enfin, il doit agir comme un interrupteur, changeant de forme en fonction des entrées et des sorties.
Il est difficile de réunir toutes « ces propriétés dans un seul système protéique », a déclaré l’équipe.
En utilisant un mélange d'AlphaFold, Rosetta et ProteinMPNN, la conception finale ressemble à une charnière. Il comporte deux parties rigides qui peuvent se déplacer l'une par rapport à l'autre, tandis qu'une autre pièce reste pliée. Normalement, la protéine est fermée. Le déclencheur est un petit peptide – une courte chaîne d’acides aminés – qui se lie aux charnières et déclenche son changement de forme. Ces soi-disant « peptides effecteurs » ont été soigneusement conçus pour être spécifiques, réduisant ainsi leurs chances de s’accrocher à des parties non ciblées.
L’équipe a d’abord ajouté des peptides déclencheurs qui brillent dans le noir à plusieurs conceptions de charnières. Une analyse ultérieure a révélé que la gâchette s’accrochait facilement à la charnière. La configuration de la protéine a changé. À titre de contrôle de cohérence, la forme était celle précédemment prédite à l’aide de l’analyse de l’IA.
Des études supplémentaires utilisant des structures cristallisées des conceptions protéiques, avec ou sans effecteur, ont davantage validé les résultats. Ces tests ont également recherché les principes de conception qui faisaient fonctionner la charnière et les paramètres qui faisaient basculer un état vers l’autre.
Les plats à emporter ? L'IA peut désormais concevoir des protéines avec deux états différents, en construisant essentiellement des transistors biologiques pour la biologie synthétique. Pour l'instant, le système n'utilise que des peptides effecteurs conçus sur mesure dans leurs études, ce qui peut limiter la recherche et le potentiel clinique. Mais selon l'équipe, la stratégie peut également s'étendre aux peptides naturels, tels que ceux qui se lient aux protéines impliquées dans la régulation de la glycémie, régulent l'eau dans les tissus ou influencent l'activité cérébrale.
"Comme les transistors dans les circuits électroniques, nous pouvons coupler les commutateurs à des sorties et entrées externes pour créer des dispositifs de détection et les intégrer dans des systèmes protéiques plus vastes", a expliqué l'équipe.
L’auteur de l’étude, le Dr Philip Leung, ajoute : « Cela pourrait révolutionner la biotechnologie de la même manière que les transistors ont transformé l’électronique. »
Crédit d'image : Ian C Haydon/UW Institute for Protein Design
- Contenu propulsé par le référencement et distribution de relations publiques. Soyez amplifié aujourd'hui.
- PlatoData.Network Ai générative verticale. Autonomisez-vous. Accéder ici.
- PlatoAiStream. Intelligence Web3. Connaissance Amplifiée. Accéder ici.
- PlatonESG. Automobile / VE, Carbone, Technologie propre, Énergie, Environnement, Solaire, La gestion des déchets. Accéder ici.
- PlatoHealth. Veille biotechnologique et essais cliniques. Accéder ici.
- GraphiquePrime. Élevez votre jeu de trading avec ChartPrime. Accéder ici.
- Décalages de bloc. Modernisation de la propriété des compensations environnementales. Accéder ici.
- La source: https://singularityhub.com/2023/08/22/ai-can-now-design-proteins-that-behave-like-biological-transistors/
- :possède
- :est
- :ne pas
- $UP
- 2020
- 3d
- a
- AC
- Selon
- avec précision
- Agis
- activité
- ajoutée
- ajoutant
- En outre
- Ajoute
- Après
- à opposer à
- AI
- Modèles AI
- algorithme
- algorithmes
- Tous
- seul
- déjà
- aussi
- Bien que
- Alzheimer
- an
- selon une analyse de l’Université de Princeton
- et les
- Une autre
- applications
- SONT
- AS
- At
- attaquer
- auteur
- et
- RETOUR
- boulanger
- basé
- BE
- before
- a commencé
- commencer
- bêta
- jusqu'à XNUMX fois
- lier
- biologie
- biotechnologie
- Bit
- Block
- Blocs
- sang
- corps
- tous les deux
- Cerveau
- Activité cérébrale
- Les cellules du cerveau
- percée
- Cassé
- construire
- Développement
- mais
- by
- Calcium
- appelé
- venu
- CAN
- prudemment
- cascade
- catalyser
- Cellules
- siècle
- chaîne
- difficile
- chances
- Change
- modifié
- en changeant
- ChatGPT
- vérifier
- Infos sur les
- fonds à capital fermé
- plus
- le cloud
- complètement
- configuration
- contrôles
- Correspondant
- pourriez
- Couples
- engendrent
- La création
- crédit
- de dall
- endommager
- David
- Décès
- Déchiffrer
- profond
- l'apprentissage en profondeur
- DeepMind
- page de livraison.
- Selon
- Conception
- principes de conception
- un
- Création de Design
- conception
- Avec nos Bagues Halo
- détermination
- développé
- Compatibles
- différent
- numérique
- Maladie
- maladies
- adn
- down
- chute
- dr
- rêve
- drogue
- Médicaments
- chacun
- même
- Edge
- non plus
- Electronique
- Electronique
- Endless
- ingénieur
- à leurs besoins.
- Environment
- Pourtant, la
- faire une éventuelle
- Chaque
- évolution
- exemple
- expansion
- expliqué
- étendre
- externe
- Photobooth
- RAPIDE
- Réactions
- finale
- finalement
- Prénom
- Flexibilité
- Pour
- Forces
- formulaire
- trouvé
- De
- gelé
- fonction
- fonctionnel
- plus
- Gain
- génératif
- IA générative
- lignes directrices
- ait eu
- Half
- arriver
- Dur
- nuire
- méfaits
- Vous avez
- Cœur
- Heart Attack
- aider
- très
- Charnière
- en espérant
- Comment
- Cependant
- HTTPS
- humain
- VÉLO
- et idées cadeaux
- imaginé
- immuable
- in
- intégrer
- de plus en plus
- infections
- influencer
- d'information
- initiale
- entrées
- à l'intérieur
- plutôt ;
- Institut
- interagit
- interne
- Internet
- développement
- impliqué
- IT
- SES
- lui-même
- Emploi
- chemin
- juste
- laboratoire
- gros
- plus importantes
- apprentissage
- niveaux
- VIE
- lumière
- comme
- LIMIT
- limites
- Gamme
- vie
- Location
- Style
- ressembler
- LOOKS
- Réduction du coût
- LES PLANTES
- a prendre une
- de nombreuses
- Mai..
- veux dire
- mesure
- médical
- message
- méthodes
- manquant
- mélanger
- numériques jumeaux (digital twin models)
- moléculaire
- Mois
- (en fait, presque toutes)
- Bougez
- plusieurs
- Nature
- Nature
- Besoins
- Nouveauté
- agréable
- NIH
- normalement
- maintenant
- nombre
- of
- présenté
- souvent
- on
- ONE
- et, finalement,
- uniquement
- sur
- ouvert
- or
- Autre
- Autres
- nos
- sortie
- paramètres
- les pièces
- pièce
- Platon
- Intelligence des données Platon
- PlatonDonnées
- Jouez
- défaillances
- l'éventualité
- solide
- prévoir
- prédit
- prévoir
- précédemment
- principes
- Profil
- propriétés
- perspective
- Protéines
- Protéines
- Rapide
- vite.
- gamme
- plutôt
- Réagit
- Réglementer
- régulateur
- relatif
- libération
- compter
- reste
- un article
- Réagir
- résultat
- résultant
- Résultats
- révolutionner
- bon
- rigide
- racine
- Courir
- Saïd
- même
- Sciences
- scientifiques
- gratter
- Deuxièmement
- secondaire
- semblait
- plusieurs
- Forme
- formes
- hangar
- décalage
- Shorts
- Peu de temps
- devrait
- signaux
- similaires
- simplement
- Sites
- Séance
- petit
- flocons de neige
- Solutions
- quelques
- sophistiqué
- suscité
- spécificité
- stabiliser
- stable
- Commencez
- Région
- États
- collage
- de Marketing
- Chaîne
- de construction
- structure
- étudié
- études
- Étude
- ultérieur
- Par la suite
- tel
- sucre
- Interrupteur
- haute
- combustion propre
- Système
- Prenez
- prend
- Exploiter
- objectifs
- équipe
- tests
- que
- qui
- Le
- leur
- Les
- puis
- Là.
- Ces
- l'ont
- chose
- penser
- this
- ceux
- fiable
- pointe
- à
- ensemble
- les outils
- transformé
- transformateurs
- déclencher
- torsion
- deux
- compréhension
- Univers
- université
- inconnu
- us
- Usages
- en utilisant
- validé
- énormément
- viral
- était
- Washington
- Eau
- Façon..
- we
- Armes
- Tissage
- web
- ont été
- qui
- tout en
- why
- comprenant
- sans
- activités principales
- vos contrats
- encore
- zéphyrnet