Az elektronika és az optikai érzékelők egycellás szinten történő egyesítése az emberi testtel egy napon lehetővé teheti az egyes sejtek valós idejű távfelügyeletét és vezérlését. Az elektronikai gyártás fejlődése lehetővé tette nanoméretű felbontású tranzisztorok és érzékelők létrehozását, míg az innovatív nanomintázó technikák lehetővé teszik ezen eszközök rugalmas hordozóra történő összeszerelését. Az ilyen eljárások azonban általában durva vegyszereket, magas hőmérsékletet vagy vákuumtechnikákat igényelnek, amelyek nem alkalmasak élő sejtek és szövetek számára.
Ezen akadályok leküzdésére a Johns Hopkins Egyetem kutatócsoportja nem mérgező, nagy felbontású és költséghatékony eljárást fejlesztett ki arany nanomintázatok élő szövetekre és sejtekre történő nyomtatására. Eredményeikről beszámolnak Nano Letters, azt mutatják be, hogy az új technika élő sejteket és szöveteket képes „tetoválni” arany nanopontok és nanoszálak rugalmas tömbjeivel. Végső soron a módszer felhasználható az intelligens eszközök és az élő szövetek integrálására olyan alkalmazásokhoz, mint a bionika és a bioérzékelés.
„Ha technológiáink lennének az izolált sejtek egészségi állapotának nyomon követésére, talán sokkal korábban diagnosztizálhatnánk és kezelhetnénk a betegségeket, és nem várnánk meg, amíg az egész szerv megsérül” – magyarázza a csoport vezetője. David Gracias sajtónyilatkozatában. „Arról beszélünk, hogy valami elektronikus tetováláshoz hasonlót helyezünk egy élő tárgyra, amely tízszer kisebb, mint egy gombostű feje. Ez az első lépés a szenzorok és elektronika élő cellákra történő csatlakoztatása felé.”
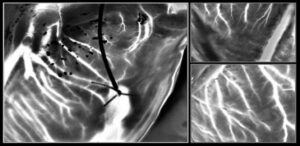
Köszönöm, Luo Gu és munkatársai egy háromlépcsős nanotranszfer nyomtatási eljárást terveztek az arany nanomintázatok élő sejtekhez való kötésére. Első lépésben a hagyományos nanoimprint litográfiát (NIL) alkalmazták arany nanopontok vagy nanohuzalok tömbjének polimer bevonatú szilícium lapkákra való nyomtatására. Ezután feloldották a polimert, felszabadítva a nanotömböket, hogy üveg fedőlemezekre vigyék át.
Ezután a kutatók az arany felületét ciszteaminnal funkcionalizálták, és az arany NIL-tömböket alginát hidrogél transzfer réteggel vonták be. Megmutatták, hogy ez a megközelítés megbízhatóan képes 8 × 8 mm-es nanopontok és nanoszálak tömbjeit átvinni az üvegből a puha és rugalmas hidrogélekre. Az utolsó lépésben az arany NIL-tömböket zselatinnal konjugálják, hogy lehetővé tegyék élő sejtekbe vagy szövetekbe való átvitelüket. A hidrogél transzferréteg disszociációja ezután feltárja az aranymintát.
A kutatók 250 nm átmérőjű aranypontokból (550 nm-es középpontok közötti távolság) vagy 300 nm széles aranyhuzalokra (450 nm-es távolság) alginát-hidrogélen oltott élő fibroblaszt sejtek viselkedését vizsgálták. Körülbelül 24 órával az oltás után a nanoszálra nyomtatott hidrogélen lévő sejtek előnyösen a nanoszálakkal párhuzamosan vándoroltak, míg a nanopontokon lévők véletlenszerű, de valamivel gyorsabb migrációt mutattak. A nanoszálakon lévő sejtek nagyjából kétszer akkora megnyúlást mutattak, mint a nanopontokon. Ezek az eredmények azt mutatják, hogy az arany NIL-tömbök képesek irányítani a sejtorientációt és a migrációt.
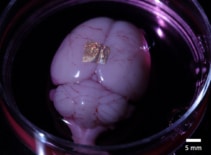
A sejtekkel és szövetekkel biológiailag kompatibilis, az alginát-hidrogél arany NIL-tömböket is képes átvinni élő szervekre és sejtekre. Ennek demonstrálására a kutatók nanohuzalra nyomtatott hidrogélt helyeztek el egy teljes agy agykérgében és egy koronális agyszeletben.
2 óra táptalajban és a hidrogél disszociációja után a nanoszálak az egész agy felszínéhez kötve maradtak. Ezzel szemben az agyszeleten lévő nanoszálak nem tapadtak meg, ami arra utal, hogy a tapadási erősség a különböző sejttípusok és tenyésztési módszerek között változik. A kutatók megjegyzik, hogy további vizsgálatokra van szükség a tapadási mechanizmusok jellemzésére és optimalizálására a robusztus, hosszú távú kötés érdekében.
Végül, hogy értékeljék a biotranszfer nyomtatást az egysejtű szinten, a kutatók egyrétegű sejtlapokat tenyésztettek arany NIL-tömbben nyomtatott alginát hidrogélen. 24 óra elteltével a fibroblaszttal beoltott hidrogéleket zselatinnal bevont fedőlemezekre fordították, és egy éjszakán át hagyták a sejteket a fedőlemezekhez tapadni.
Az alginát-hidrogél disszociációja után a fluoreszcens mikroszkópos vizsgálat kimutatta, hogy az arany nanopontokkal mintázott fibroblasztok életképessége körülbelül 97%, míg a nanoszálakkal mintázottak életképessége körülbelül 98%, ami azt jelzi, hogy a nyomtatási folyamat biokompatibilis az élő sejtekkel. A mintás fibroblaszt sejtlapon látható fényvisszaverő színek arra utalnak, hogy az arany NIL-tömb alakja megmaradt.
A gyártási folyamat kompatibilis a mikroméretű fotolitográfiával is, amely lehetővé tette a kutatók számára, hogy 200 µm széles, hatszögletű és háromszög alakú arany NIL-tömb foltokat hozzanak létre. Ezután biotranszferrel ezeket sejtlapokra nyomtatták, ami a fibroblaszt sejtek szelektív növekedéséhez vezetett a mikrofoltokon. A 16 órán keresztül felvett filmek azt mutatták, hogy a nanoszálak tetejére nyomtatott foltokkal ellátott sejtek egészségesnek és vándorlóképesnek tűntek, a tömbök pedig a puha cellákon maradtak még mozgás közben is.

Az apró szenzor egyszerre méri a szívsejtek elektromos és mechanikai aktivitását
„Megmutattuk, hogy képesek vagyunk összetett nanomintákat csatolni élő sejtekhez, miközben biztosítjuk, hogy a sejt ne pusztuljon el” – mondja Gracias. "Nagyon fontos eredmény, hogy a sejtek együtt tudnak élni és mozogni a tetoválásokkal, mert gyakran jelentős inkompatibilitás van az élő sejtek és a mérnökök által az elektronika gyártására használt módszerek között."
Gracias és munkatársai arra a következtetésre jutottak, hogy a nanomintázati folyamatuk a szabványos mikrogyártási technikákkal kombinálva „lehetőséget nyit új sejtkultúra szubsztrátok, biohibrid anyagok, bionikus eszközök és bioszenzorok kifejlesztésére”. Ezt követően azt tervezik, hogy megpróbálnak bonyolultabb nanoáramköröket csatlakoztatni, amelyek hosszabb ideig a helyükön maradhatnak, valamint kísérletezni fognak különböző típusú cellákkal.
- SEO által támogatott tartalom és PR terjesztés. Erősödjön még ma.
- PlatoData.Network Vertical Generative Ai. Erősítse meg magát. Hozzáférés itt.
- PlatoAiStream. Web3 Intelligence. Felerősített tudás. Hozzáférés itt.
- PlatoESG. Autóipar / elektromos járművek, Carbon, CleanTech, Energia, Környezet, Nap, Hulladékgazdálkodás. Hozzáférés itt.
- PlatoHealth. Biotechnológiai és klinikai vizsgálatok intelligencia. Hozzáférés itt.
- ChartPrime. Emelje fel kereskedési játékát a ChartPrime segítségével. Hozzáférés itt.
- BlockOffsets. A környezetvédelmi ellentételezési tulajdon korszerűsítése. Hozzáférés itt.
- Forrás: https://physicsworld.com/a/researchers-tattoo-gold-nanopatterns-onto-live-cells/
- :van
- :is
- :nem
- $ UP
- 16
- 200
- 24
- 8
- a
- képesség
- Képes
- Rólunk
- tevékenység
- tapad
- előlegek
- Után
- Is
- között
- an
- és a
- megjelent
- alkalmazások
- megközelítés
- körülbelül
- VANNAK
- körül
- Sor
- AS
- Assembly
- értékeli
- At
- csatolja
- BE
- mert
- hogy
- között
- test
- kötvény
- Agy
- de
- TUD
- Cellák
- jellemez
- kettyenés
- munkatársai
- kombinált
- összeegyeztethető
- bonyolult
- megállapítja,
- kontraszt
- ellenőrzés
- hagyományos
- költséghatékony
- tudott
- teremt
- kultúra
- nap
- bizonyítani
- tervezett
- fejlett
- Fejlesztés
- Eszközök
- DID
- az
- különböző
- betegségek
- Nem
- Korábban
- Elektronikus
- Elektronika
- lehetővé
- engedélyezve
- Mérnökök
- biztosítása
- Egész
- Még
- Elmagyarázza
- gyorsabb
- utolsó
- megállapítások
- vezetéknév
- rugalmas
- A
- ból ből
- további
- GAO
- általában
- üveg
- Arany
- Növekedés
- útmutató
- kellett
- Legyen
- fej
- Egészség
- egészséges
- Szív
- Magas
- nagy felbontású
- Hopkins
- azonban
- HTTPS
- emberi
- kép
- fontos
- in
- egyéni
- információ
- újító
- integrálni
- izolált
- kérdés
- IT
- Johns
- Johns Hopkins University
- jpg
- réteg
- vezető
- vezető
- hadd
- szint
- mint
- él
- élő
- hosszú lejáratú
- hosszabb
- készült
- anyagok
- max-width
- talán
- intézkedések
- mechanikai
- mechanizmusok
- Média
- megy
- módszer
- mód
- Mikroszkópia
- vándorol
- vándoroltak
- elvándorlás
- ellenőrzés
- több
- mozog
- áthelyezve
- Filmek
- sok
- szükséges
- Új
- következő
- tárgy
- akadályok
- of
- gyakran
- on
- ONE
- -ra
- nyitva
- Lehetőségek
- Optimalizálja
- or
- felett
- Overcome
- éjszakai
- Párhuzamos
- Patches
- Mintás
- időszakok
- Fizika
- Fizika Világa
- Hely
- terv
- Plató
- Platón adatintelligencia
- PlatoData
- pozicionált
- lehetséges
- nyomja meg a
- nyomtatás
- folyamat
- Folyamatok
- elhelyezés
- véletlen
- PATKÁNY
- igazi
- real-time
- feljegyzett
- maradt
- megmaradó
- távoli
- Jelentő
- szükség
- kutatás
- kutatók
- Felbontás
- eredményez
- Revealed
- erős
- nagyjából
- azt mondja,
- látott
- szelektív
- érzékelők
- Alak
- adatlap
- kimutatta,
- mutatott
- jelentős
- Szilícium
- egyszerre
- Szelet
- kisebb
- okos
- Puha
- valami
- standard
- nyilatkozat
- tartózkodás
- Lépés
- erő
- tanulmányok
- ilyen
- javasol
- felületi
- beszéd
- csapat
- technikák
- Technologies
- tíz
- mint
- hogy
- A
- azok
- akkor
- Ezek
- ők
- ezt
- azok
- miniatűr
- idő
- alkalommal
- nak nek
- felső
- felé
- vágány
- átruházás
- kezelésére
- igaz
- megpróbál
- Kétszer
- típusok
- Végül
- egyetemi
- -ig
- használ
- használt
- Vákuum
- nagyon
- életképesség
- várjon
- volt
- we
- JÓL
- mivel
- ami
- míg
- egész
- széles
- val vel
- világ
- zephyrnet