Egy új típusú számítógépes modell, amely sejtszinten képes feltárni a sugárkárosodást, javíthatja a tüdőrákos betegek sugárkezelési eredményeit.
Római Bauer, a számítástechnikai idegtudós a Surrey Egyetem az Egyesült Királyságban, együttműködésben Marco Durante és a Nicolò Cogno ból ből GSI Helmholtzzentrum für Schwerionenforschung Németországban létrehozta azt a modellt, amely sejtről sejtre szimulálja a sugárzás és a tüdő közötti kölcsönhatást.
A tüdőrákos betegek több mint felét sugárterápiával kezelik. Bár ez a megközelítés hatékony, a recipiensek akár 30%-a is sugárzás okozta sérüléseket okoz. Ezek súlyos, légzést befolyásoló állapotokat válthatnak ki, például fibrózist – amelyben a tüdőben lévő alveolusok (légzsákok) bélése megvastagodik és megmerevedik – és tüdőgyulladást – amikor az alveolusok fala begyullad.
Az egészséges szövetek sugárkárosodásának korlátozása érdekében, miközben továbbra is elpusztítja a rákos sejteket, a sugárterápiát több külön „frakcióban” szállítják. Ez lehetővé teszi, hogy összességében magasabb – és ennélfogva hatékonyabb – adagot adjunk be, mivel a sérült egészséges sejtek egy része az egyes frakciók között képes helyreállítani magát.
Jelenleg a sugárterápiás frakcionálási sémákat a múltbeli tapasztalatok és az általánosított statisztikai modellek alapján választják ki, ezért nincsenek optimalizálva az egyes betegekre. Ezzel szemben ennek az új modellnek köszönhetően személyre szabott orvoslás érhető el, amely Durante, a Biofizikai Tanszék a GSI-nél kifejti, megvizsgálja „a szövetek toxicitását az alapvető sejtreakcióktól kezdve, és ezért képes megjósolni, hogy mi történik bármely pácienssel”, ha különböző frakcionálási sémákat választanak.
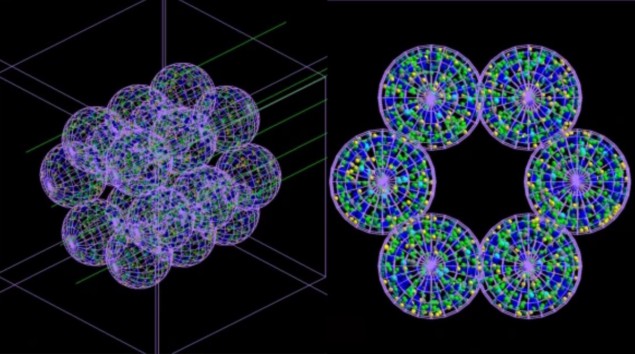
A csapat kifejlesztett egy „ágens-alapú” modellt (ABM), amely külön kölcsönható egységekből vagy ágensekből áll – amelyek ebben az esetben a tüdősejteket imitálják – Monte Carlo szimulátorral párosítva. pontjában leírt ABM Kommunikációs orvostudomány18, egyenként 260 µm átmérőjű alveolusból álló alveoláris szegmenst ábrázol. Ezután ezeknek az alveolusoknak a besugárzásának Monte Carlo-szimulációját végezzük mikroszkopikus és nanoszkopikus léptékben, és az egyes sejtekhez eljuttatott sugárdózisról és annak eloszlásáról szóló információkat visszacsatolják az ABM-be.
Az ABM ezt az információt felhasználja annak meghatározására, hogy az egyes cellák életben maradnak-e vagy meghalnak, és a végeredményt 3D-s kép formájában adja ki. Lényeges, hogy a csatolt modell képes szimulálni az idő múlását, és így megmutatja a sugárkárosodás súlyosságát – és az általa okozott egészségügyi állapotok előrehaladását – órákkal, napokkal, hónapokkal vagy akár évekkel a kezelés után.
„Nagyon izgalmasnak találtam, hogy ezek a számítási szimulációk valóban olyan eredményeket hoztak, amelyek megfeleltek a különböző csoportok, laboratóriumok és kórházak különböző kísérleti megfigyeléseinek. Tehát a számítástechnikai megközelítésünket elvileg klinikai környezetben is használhatjuk” – mondja Bauer, a nemzetközi szervezet szóvivője. BioDynaMo együttműködés, melynek célja új számítási módszerek bevezetése az egészségügybe a modell felépítéséhez használt szoftvercsomagon keresztül.
Bauer azután kezdett el számítógépes rákmodelleken dolgozni, hogy egy közeli barátja mindössze 34 évesen meghalt a betegségben. „Minden rák más és minden ember más, különböző alakú szervekkel, genetikai hajlamokkal és életmóddal” – magyarázza. Reméli, hogy a szkennelésekből, biopsziákból és egyéb tesztekből származó információkat be lehet vinni az új modellbe, hogy képet kapjanak minden egyes személyről. Ezután létre lehetne hozni egy mesterséges intelligencia által támogatott terápiás protokollt, amely egy szorosan testreszabott kezelési tervet adna ki, amely javítja a beteg túlélési esélyeit.
A betegspecifikus tervezés javíthatja a sugárterápia eredményeit
A Bauer jelenleg más tudományágak munkatársait keresi, beleértve a fizikát is, hogy segítsenek elmozdulni a tüdőrákos betegek több éven át tartó klinikai vizsgálatára. Eközben a csapat a modell használatát az orvostudomány más területeire is ki kívánja terjeszteni.
Durante például azt reméli, hogy ezzel a tüdőmodellel tanulmányozhatja a vírusfertőzést, mivel „előre jelezheti a COVID-19 fertőzés által kiváltott tüdőgyulladást”. Mindeközben Bauer elkezdte szimulálni a koraszülöttek agyában zajló áramkörök fejlődését, azzal a céllal, hogy jobban megértse, „milyen időpontban kell beavatkozni és hogyan”.
- SEO által támogatott tartalom és PR terjesztés. Erősödjön még ma.
- PlatoData.Network Vertical Generative Ai. Erősítse meg magát. Hozzáférés itt.
- PlatoAiStream. Web3 Intelligence. Felerősített tudás. Hozzáférés itt.
- PlatoESG. Carbon, CleanTech, Energia, Környezet, Nap, Hulladékgazdálkodás. Hozzáférés itt.
- PlatoHealth. Biotechnológiai és klinikai vizsgálatok intelligencia. Hozzáférés itt.
- Forrás: https://physicsworld.com/a/modelling-lung-cells-could-help-personalize-radiotherapy/
- :van
- :is
- :nem
- $ UP
- 135
- 3d
- a
- Képes
- Rólunk
- AC
- elért
- tulajdonképpen
- beadott
- érint
- Után
- idős
- szerek
- célok
- AIR
- Minden termék
- lehetővé teszi, hogy
- Bár
- an
- és a
- bármilyen
- megközelítés
- VANNAK
- területek
- AS
- At
- vissza
- alapján
- alapvető
- alap
- BE
- mert
- válik
- kezdődött
- megkezdett
- Jobb
- között
- lélegző
- hoz
- épít
- épít
- by
- TUD
- Rák
- Ráksejtek
- végrehajtott
- eset
- Okoz
- sejt
- Cellák
- esély
- választott
- Klinikai
- közel
- szorosan
- együttműködés
- együttműködők
- számítási
- számítógép
- Körülmények
- Összeáll
- kontraszt
- tudott
- összekapcsolt
- Covid-19
- készítette
- döntően
- Jelenleg
- kár
- Nap
- szállított
- osztály
- leírt
- fejlett
- Fejlesztés
- az
- meghalt
- különböző
- Igazgató
- tudományok
- betegség
- terjesztés
- adag
- minden
- Hatékony
- Még
- Minden
- izgalmas
- Bontsa
- tapasztalat
- kísérleti
- Elmagyarázza
- Fed
- utolsó
- következő
- A
- forma
- talált
- töredék
- barát
- ból ből
- általánosított
- genetikai
- Németország
- cél
- Csoportok
- fél
- megtörténik
- he
- egészségügyi
- egészséges
- segít
- <p></p>
- övé
- remény
- remélve
- kórházak
- NYITVATARTÁS
- Hogyan
- HTTPS
- i
- javul
- javítja
- in
- Beleértve
- egyéni
- információ
- sérülések
- példa
- szándékozik
- kölcsönható
- kölcsönhatásba lép
- Nemzetközi
- beavatkozik
- bele
- kérdés
- IT
- ITS
- jpg
- éppen
- gyilkos
- Labs
- szint
- életmód
- LIMIT
- bélés
- él
- MEGJELENÉS
- párosított
- max-width
- Lehet..
- Közben
- orvosi
- orvostudomány
- mód
- mikroszkopikus
- modell
- modellezés
- modellek
- hónap
- több
- mozog
- Természet
- Új
- következő
- of
- on
- optimalizált
- or
- érdekében
- Más
- mi
- ki
- eredmények
- teljesítmény
- kimenetek
- felett
- átfogó
- átjáró
- múlt
- beteg
- betegek
- person
- megszemélyesít
- Személyre
- Fizika
- Fizika Világa
- kép
- terv
- tervezés
- Plató
- Platón adatintelligencia
- PlatoData
- pont
- előre
- Idő előtti
- alapelv
- haladás
- protokoll
- ad
- Sugárkezelés
- reakciók
- címzettek
- javítás
- képviselet
- Eredmények
- mutatják
- azt mondja,
- Skála
- vizsgál
- rendszerek
- keres
- részes
- különálló
- súlyos
- beállítás
- számos
- alakú
- előadás
- szimulálni
- szimulációk
- szimulátor
- So
- szoftver
- néhány
- szóvivő
- Kezdve
- statisztikai
- Még mindig
- Tanulmány
- ilyen
- kíséret
- Surrey
- túlélés
- szabott
- csapat
- tesztek
- Kösz
- hogy
- A
- Az Egyesült Királyságban
- maguk
- akkor
- terápia
- ebből adódóan
- Ezek
- ezt
- miniatűr
- Így
- idő
- nak nek
- felé
- kezelt
- kezelés
- próba
- kiváltó
- igaz
- típus
- Uk
- megértés
- egységek
- használ
- használt
- használ
- segítségével
- különféle
- nagyon
- keresztül
- vírusos
- Mit
- amikor
- vajon
- ami
- míg
- val vel
- belül
- Munka
- dolgozzanak ki
- dolgozó
- világ
- lenne
- év
- zephyrnet