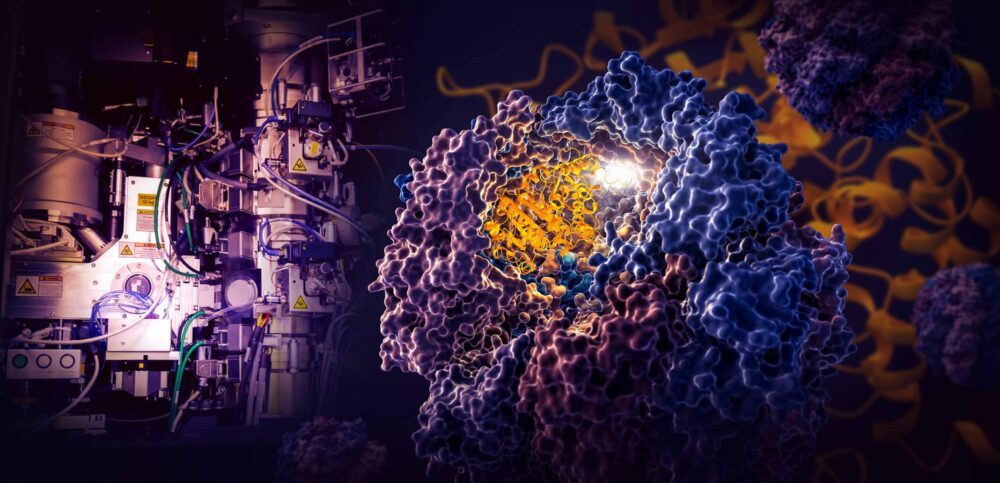
Az Energiaügyi Minisztérium SLAC National Accelerator Laboratóriumának és a Stanford Egyetem kutatóinak mérföldkőnek számító tanulmánya feltárja, hogy a TRiC nevű apró sejtes gép hogyan irányítja a tubulin, egy emberi fehérje feltekeredését, amely a sejt állványzataként és szállítórendszereként szolgáló mikrotubulusok építőköve. .
Eddig a tudósok úgy gondolták, hogy a TRiC és a hasonló gépek, az úgynevezett chaperoninok, passzívan biztosítják a hajtogatást elősegítő környezetet, de közvetlenül nem vesznek részt benne.
A kutatók becslése szerint a sejtjeinkben, valamint a növényekben és állatokban lévő fehérjék akár 10%-a is gyakorlati segítséget kap ezekből a kis kamrákból, hogy végleges, aktív formájukba hajthassák.
Judith Frydman, a Stanford professzora, a tanulmány egyik vezető szerzője, a TRiC segítségével feltekeredő fehérjék nagy része szorosan kapcsolódik az emberi betegségekhez, beleértve bizonyos rákos megbetegedéseket és neurodegeneratív rendellenességeket, mint a Parkinson-, Huntington- és Alzheimer-kór.
Valójában sok rákellenes gyógyszert úgy terveztek, hogy megzavarják a tubulint és az általa képződő mikrotubulusokat, amelyek nagyon fontosak a sejtosztódáshoz. Tehát a TRIC-vel segített tubulin hajtogatási folyamat megcélzása vonzó rákellenes stratégia lehet.
A csapat egy évtizedes tanulmányának eredményeiről számolt be egy ben megjelent cikkben Sejt Ma.
"Ez a legizgalmasabb fehérjeszerkezet, amin dolgoztam 40 éves pályafutásom során" – mondta a SLAC/Stanford professzor, Wah Chiu, a kriogén elektronmikroszkóp (cryo-EM) fejlesztésének és használatának úttörője, valamint a SLAC krio-EM és bioimaging részlegének igazgatója.
„Amikor 20 évvel ezelőtt megismerkedtem Judittal” ő mondta, „Arról beszéltünk, hogy látjuk-e a fehérjék összehajtogatását. Ez az, amivel az emberek évek óta próbálkoztak, és most megtettük.”
A kutatók a TRiC által irányított hajtogatási folyamat négy különálló lépését rögzítették a krio-EM segítségével, közel atomi felbontással, és megerősítették a látottakat biokémiai és biofizikai elemzésekkel.
Frydman szerint a legalapvetőbb szinten ez a tanulmány megoldja azt a régóta fennálló rejtélyt, hogy a tubulin miért nem tud összehajtani a TRiC segítsége nélkül: "Ez valóban megváltoztatja a játékot azáltal, hogy végre új módot hoz annak megértésére, hogy a fehérjék hogyan hajtogatnak az emberi sejtben."
Spagetti hajtogatása virágokká
A fehérjék alapvető szerepet játszanak szinte mindenben, amit egy sejt csinál, és annak kiderítése, hogyan alakulnak át végső 3D-s állapotukba, az egyik legfontosabb kémia és biológia.
Ahogy Chiu mondja, "Egy fehérje aminosavakból indul ki, és úgy néz ki, mint a spagetti, de addig nem tud működni, amíg megfelelő formájú virággá nem hajtogatják."
Az 1950-es évek közepe óta az Országos Egészségügyi Intézet kutatója, Christian Anfinsen kisméretű fehérjékkel végzett kísérletei alakították ki a fehérjék hajtogatásának képét. Felfedezte, hogy ha egy kis fehérjét széthajtogat, az spontán módon visszaugrik ugyanabba az alakba, és arra a következtetésre jutott, hogy az erre vonatkozó utasításokat a fehérje aminosavszekvenciája kódolja. Anfinsen megosztotta az 1972-es Nobel-díjat kémia ezért a felfedezésért.
Harminc évvel később a kutatók felfedezték, hogy speciális sejtes gépek segítik a fehérjék felhajtását. Ám az elterjedt nézet az volt, hogy funkciójuk arra korlátozódott, hogy segítsék a fehérjéket spontán hajtogatásukban azáltal, hogy megóvják őket a csapdába eséstől vagy összeomlástól.
A segítő gépek egyik típusa, az úgynevezett chaperonin, egy hordószerű kamrát tartalmaz, amely a fehérjéket tartalmazza, miközben hajtogatják őket. A TRIC ebbe a kategóriába tartozik.
A TRiC kamra egyedülálló abban, hogy nyolc különböző alegységből áll, amelyek két egymásra helyezett gyűrűt alkotnak. A tubulin fehérje hosszú, vékony szálát egy medúza alakú segítő molekula juttatja be a kamra nyílásába. Ezután a kamra fedele bezárul, és elkezdődik a hajtogatás. Ha kész, kinyílik a fedél, és a kész, hajtogatott tubulin távozik.
Mivel a tubulin nem tud hajtogatni TRiC nélkül, úgy tűnt, hogy a TRiC többet tehet, mint hogy passzívan segíti a tubulin spontán hajtogatását. De hogyan is működik ez pontosan? Ez az új tanulmány választ ad erre a kérdésre, és bebizonyítja, hogy legalábbis az olyan fehérjékre, mint a tubulin, a „spontán hajtogatás” koncepciója nem érvényes. Ehelyett a TRiC közvetlenül megszervezi a megfelelő alakú fehérjéhez vezető hajtogatási útvonalat.
Bár a mesterséges intelligencia vagy a mesterséges intelligencia legújabb fejlesztései megjósolhatják a legtöbb fehérje kész, hajtogatott szerkezetét, Frydman szerint a mesterséges intelligencia nem mutatja meg, hogyan éri el a fehérje megfelelő alakját. Ez a tudás alapvető fontosságú a sejten belüli redősödés szabályozásában és a foltosodási betegségek terápiáinak kidolgozásában. E cél elérése érdekében a kutatóknak ki kell találniuk a sejtben végbemenő hajtogatási folyamat részletes lépéseit.
Egy cellás kamra veszi át az irányítást
Tíz évvel ezelőtt Frydman, Chiu és kutatócsoportjaik úgy döntöttek, hogy mélyebbre ássák a TRIC-kamrában zajló eseményeket.
"A baktériumok chaperoninjainak egyszerűbb összehajtható kamráihoz képest az emberi sejtekben lévő TRiC egy nagyon érdekes és bonyolult gép." – mondta Frydman. "Nyolc alegysége mindegyike különböző tulajdonságokkal rendelkezik, és külön felületet mutat be a kamrában, és ez nagyon fontosnak bizonyul."
A tudósok felfedezték, hogy ennek az egyedülálló kamrának a belseje kétféleképpen irányítja a hajtogatási folyamatot.

(Yanyan Zhao/Stanford University)
Ahogy a kamra fedele bezárul egy fehérje fölé, elektrosztatikus töltések jelennek meg a belső falakon. Vonzzák a tubulin fehérjeszál ellentétes töltésű részeit, és lényegében a falhoz tapadnak, hogy megfelelő formát és konfigurációt hozzanak létre a hajtogatás következő lépéséhez. Eközben a kamra falán lelógó TRIC alegység „farok” meghatározott időpontokban és helyeken megragadja a tubulin fehérjét, hogy rögzítse és stabilizálja azt.
Kezdésként a tubulinszál egyik vége egy kis zsebbe akasztódik a falban, és összecsukódik. Ezután a másik vége egy másik helyre csatlakozik, és nagy hurkot hoz létre. A hurok úgy hajtódik össze, hogy közvetlenül az első hajtogatott terület mellé kerüljön.
A harmadik lépésben a középső rész egy része összehajlik, és kialakítja a fehérje magját, valamint a zsebeket, amelyekbe a GTP, egy olyan molekula, amely energiát raktároz és bocsát ki a sejt munkájához, be tud kapcsolódni.
Végül a fennmaradó fehérje rész felhajlik. A tubulin molekula készen áll a cselekvésre.
"A hajtogatási szekvencia közbenső szakaszairól készült szerkezeti pillanatfelvételeket még soha nem láttak krioelektronmikroszkóppal." – mondta Frydman.
A technikák erőteljes keveréke
Csapata megerősítette a hajtogatási sorrendet egy kihívást jelentő biokémiai és biofizikai tesztsorozattal, amely évek munkáját követelte.
Az eredmények értelmezése lehetővé tette a kutatóknak, hogy képet alkossanak a tubulin változó alakjáról, amint az a TRiC kamrában behajlik, ami megegyezett a krio-EM által generált képekkel.
"Nagyon erős, hogy képes vagy oda-vissza mozogni ezek között a technikák között, mert akkor valóban tudhatod, hogy amit látsz, az tükrözi azt, ami a cellában történik." – mondta Frydman.
„A tudomány egy igazán érdekes megoldással lepett meg minket, amit nem is sejtettem volna.”
A tanulmány arra is szolgál, hogy megértsük, hogyan fejlődött ki ez a hajtogatási rendszer a növényeket, állatokat és embereket alkotó eukarióta sejtekben, de nem az egyszerűbb sejtekben, mint például a baktériumok és az archaea sejtjei. Ahogy a fehérjék egyre összetettebbé váltak az eukarióta sejtek szükségleteinek kielégítésére, a kutatók azt sugallják, hogy egy bizonyos ponton nem tudták olyan formába hajtani, amilyenre szükségük volt a bonyolultabb feladatok elvégzéséhez, kis segítség nélkül. Az eukarióta fehérjék és chaperoninkamrájuk valószínűleg együtt fejlődtek ki, valószínűleg az összes eukarióta szervezet utolsó közös ősével kezdődően, mintegy 2.7 milliárd évvel ezelőtt.
Az elemzések összetettsége és a világjárvány közjátéka miatt a tanulmány olyan sokáig tartott, hogy sokan, akik dolgoztak rajta, más munkahelyekre váltottak át. Köztük van Daniel Gestaut és Miranda Collier posztdoktori kutatók Frydman csoportjából, akik elvégezték a projekt biokémiai részét, és előmozdították azt, valamint Yanyan Zhao, Soung-Hun Roh, Boxue Ma és Greg Pintilie Chiu csoportjából, akik a kriót végezték. -EM elemzések. További közreműködők között szerepelt Junsun Park, a Roh csoport egyik diákja és Alexander Leitner, a zürichi ETH-tól (Svájc).
A munkát az NIH Wah Chiu és Judith Frydman, valamint Soung-Hun Roh, aki jelenleg a Szöuli Nemzeti Egyetem adjunktusa, a Koreai Nemzeti Kutatási Alapítvány és a Suh Kyungbae Foundation (SUHF) támogatásával támogatták.
Folyóiratcikk
- Daniel Gestaut és munkatársai, A humán chaperonin TRiC/CCT által irányított tubulin felhajtási útvonal strukturális megjelenítése. Sejt, 8. december 2022. DOI: 10.1016 / j.cell.2022.11.014