Rhodopsin, protein yang memungkinkan manusia dan vertebrata lainnya merasakan cahaya, termasuk dalam keluarga reseptor berpasangan protein G (GPCR) yang peka terhadap cahaya. Ini muncul pertama kali dalam jalur transduksi sinyal untuk memulai penglihatan. Setelah ia menyerap foton, perubahan konformasi langsung (dalam 200 fs) terjadi di retinal, sebuah kromofor yang terletak di dalam rhodopsin. Perubahan struktural awal ini memulai proses transduksi sinyal seluler yang menentukan tahap awal penglihatan. Namun, rincian kejadian intramolekul real-time melalui retina yang terfotoaktifasi menginduksi peristiwa aktivasi di dalam rhodopsin masih belum jelas.
Untuk mengisi kesenjangan pengetahuan ini, para peneliti di Institut Paul Scherrer (PSI) di Swiss menggunakan kristalografi penyelesaian waktu ultracepat untuk mempelajari perubahan konformasi rhodopsin setelah ia menyerap foton. Temuan mereka, dilaporkan dalam Alam, jelaskan bagaimana retinal hanya menyerap sebagian energi foton, menyimpan sisa energi untuk memicu perubahan konformasi yang terkait dengan pembentukan keadaan sinyal pengikatan protein G.
Untuk merekam dan menganalisis mekanisme aktivasi kromofor retina pada skala atom, dan dengan resolusi temporal ultracepat (picosecond), tim menggunakan kristalografi serial femtosecond (TR-SFX) yang diselesaikan dengan waktu pada suhu kamar.
Untuk percobaan mereka, para peneliti pertama-tama menumbuhkan mikrokristal rhodopsin berkualitas tinggi, dan kemudian menggunakan TR-SFX untuk menghasilkan serangkaian gambar pola difraksi kristal tersebut. Lebih tepatnya, mereka menggunakan pulsa laser optik untuk mengaktifkan fotomolekul protein dalam kristal dan kemudian – setelah jeda waktu tertentu – mereka menyelidiki struktur tersebut dengan pulsa sinar-X dari laser elektron bebas sinar-X (XFEL). Merekam dengan XFEL, yang merupakan kamera berkecepatan sangat tinggi, para peneliti mengumpulkan bingkai serial dari puluhan ribu kristal yang diorientasikan secara acak.

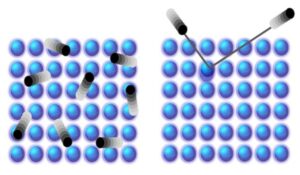
Analisis yang dilakukan oleh tim meliputi pemodelan struktur rhodopsin untuk perubahan kerapatan elektron serta penyempurnaan struktur terhadap pengamatan kristalografi. Hal ini mengungkapkan bahwa isomerisasi yang diinduksi cahaya (di mana suatu molekul beralih di antara dua konformasi yang berbeda) dengan lengkungan pada kromofor retina bertahan selama 1 ps, mengingat bahwa zat antara rhodopsin yang metastabil pertama muncul 200 fs setelah fotoaktivasi. Kemudian 100 ps kemudian, struktur rhodopsin mengambil konformasi yang lebih longgar. Dengan demikian, hasilnya menunjukkan bahwa protein tersebut menggunakan zona aktif (atau fungsional) dari jalur struktural GPCR untuk disipasi energi.

Menghubungkan titik-titik untuk memulihkan penglihatan secara artifisial
Salah satu hal yang menarik dari studi baru ini adalah bahwa struktur suhu kamar mengungkapkan kerapatan elektron untuk semua molekul air fungsional dan struktural yang telah dijelaskan sebelumnya, termasuk molekul-molekul yang kemudian berperan dalam proses fotoaktivasi. Para peneliti mencatat bahwa struktur sebelumnya yang diselesaikan dalam kondisi kriogenik gagal mencapai hal ini. Akibatnya, struktur rhodopsin SFX resolusi tinggi yang baru menampilkan keseluruhan jaringan ikatan hidrogen yang dimediasi air di dalam protein.
Penyelidikan ini menyoroti tahap awal penglihatan, mengungkapkan bahwa disipasi energi ultracepat pada rhodopsin terjadi melalui residu jalur aktivasi GPCR yang dilestarikan, membuka jalan untuk mempelajari peristiwa aktivasi awal dalam keluarga GPCR terbesar ini (kelas A).
- Konten Bertenaga SEO & Distribusi PR. Dapatkan Amplifikasi Hari Ini.
- PlatoAiStream. Kecerdasan Data Web3. Pengetahuan Diperkuat. Akses Di Sini.
- Mencetak Masa Depan bersama Adryenn Ashley. Akses Di Sini.
- Beli dan Jual Saham di Perusahaan PRE-IPO dengan PREIPO®. Akses Di Sini.
- Sumber: https://physicsworld.com/a/ultrafast-imaging-sheds-light-on-the-earliest-stages-of-vision/
- :adalah
- 1
- 100
- 200
- a
- atas
- Mencapai
- Activation
- aktif
- Setelah
- terhadap
- Semua
- an
- analisa
- Analisis
- dan
- muncul
- ADALAH
- terkait
- At
- mulai
- milik
- antara
- biologi
- ikatan
- by
- kamar
- perubahan
- Perubahan
- kimia
- kelas
- Klik
- rekan
- datang
- Kondisi
- Karena itu
- Kristal
- menunda
- dijelaskan
- rincian
- Diego
- berbeda
- Divisi
- Awal
- efektif
- memungkinkan
- energi
- keseluruhan
- peristiwa
- eksperimen
- Menjelaskan
- Gagal
- keluarga
- mengisi
- Temuan
- Pertama
- Untuk
- pembentukan
- Gratis
- dari
- FS
- Bahan bakar
- fungsionil
- celah
- menghasilkan
- diberikan
- Memiliki
- kepala
- berkualitas tinggi
- resolusi tinggi
- Menyoroti
- Seterpercayaapakah Olymp Trade? Kesimpulan
- Namun
- HTTPS
- Manusia
- hidrogen
- gambar
- gambar
- Pencitraan
- Segera
- in
- termasuk
- Termasuk
- informasi
- Inisiat
- investigasi
- isu
- IT
- NYA
- jpg
- pengetahuan
- terbesar
- laser
- kemudian
- cahaya
- terletak
- cara
- max-width
- mekanisme
- metastabil
- pemodelan
- molekul
- lebih
- Alam
- jaringan
- New
- of
- on
- sekali
- hanya
- Buka
- or
- Lainnya
- bagian
- pola
- Paving
- terus berlanjut
- fotografi
- Fisika
- Dunia Fisika
- plato
- Kecerdasan Data Plato
- Data Plato
- tepat
- sebelumnya
- sebelumnya
- proses
- proses
- Protein
- nadi
- acak
- real-time
- catatan
- rekaman
- tinggal
- yang tersisa
- Dilaporkan
- penelitian
- peneliti
- peneliti
- Resolusi
- diselesaikan
- mengembalikan
- Hasil
- Terungkap
- mengungkapkan
- Mengungkapkan
- Peran
- Kamar
- s
- Skala
- rasa
- serial
- Seri
- set
- Bentuknya
- Gudang
- ditunjukkan
- Sinyal
- ditentukan
- magang
- Negara
- menyimpan
- struktural
- struktur
- Belajar
- menyarankan
- Swiss
- tim
- memiliki
- bahwa
- Grafik
- mereka
- kemudian
- dengan demikian
- mereka
- ini
- itu
- ribuan
- Melalui
- kuku ibu jari
- waktu
- untuk
- bersama
- benar
- dua
- bawah
- bekas
- memanfaatkan
- sangat
- penglihatan
- air
- Cara..
- yang
- dengan
- dalam
- dunia
- x-ray
- zephyrnet.dll
- zona