Rick Muda adalah seorang profesor biologi di MIT yang mempelajari RNA yang ditranskripsi dari bagian genom yang tidak mengkode protein, yang dikenal sebagai DNA non-coding. Bagian genom ini pernah disebut sebagai 'DNA sampah', yang memberi Anda gambaran tentang apa yang dipikirkan banyak orang tentang nilainya. Para ilmuwan terkejut menemukan bahwa itu membentuk 98% dari genom manusia, yang memicu pencarian untuk menemukan fungsinya.
Dalam percakapan ini, Rick Young mengobrol dengan Hanne Winarsky dari Bio Eats World dan mitra umum a16z Jorge Conde, yang memimpin investasi di persimpangan biologi, ilmu komputer, dan teknik. Sebelum bergabung dengan a16z, Conde adalah Chief Strategy Officer di Syros Pharmaceuticals dan ikut mendirikan perusahaan interpretasi genomik Knome.
Percakapan mencakup apa yang telah kami pelajari tentang 98% genom yang kami pikir adalah sampah. Ternyata, ia memiliki beragam pekerjaan mulai dari menyembunyikan bukti infeksi virus purba hingga membuat setiap wajah terlihat unik. Mereka juga membahas perannya yang besar tetapi masih kurang dipahami dalam penyakit, dan bagaimana mempelajari DNA sampah mengarah pada penemuan sakelar hidup/mati gen yang tidak diharapkan oleh siapa pun.
Catatan: percakapan ini awalnya diterbitkan sebagai episode dari Bio Makan Dunia. Anda dapat mendengarkan episode itu di sini.
HANNE WINARSKY: Kami di sini untuk berbicara hari ini tentang apa yang disebut DNA sampah. Bisakah kita mulai dengan definisi sederhana?
RICK YOUNG: Itu sekitar setengah abad istilah tua. Para ilmuwan tahu tentang bagian genom yang tidak mengkode protein, dan mereka berteori bahwa ini adalah sampah. Kami tahu beberapa di antaranya hanyalah sisa-sisa invasi virus purba pada genom. Tapi ungkapan itu, DNA sampah, telah menghantui kita.
HANNE: Jadi apa istilah yang Anda coba gunakan? Materi gelap DNA yang semakin kita pahami setiap hari?
RICK: DNA non-coding.
HANNE: Mengapa mereka menganggapnya sebagai detritus? Anda telah menyebutkan beberapa di antaranya adalah sisa virus lama. Tapi kenapa tidak misteri saja dari awal?
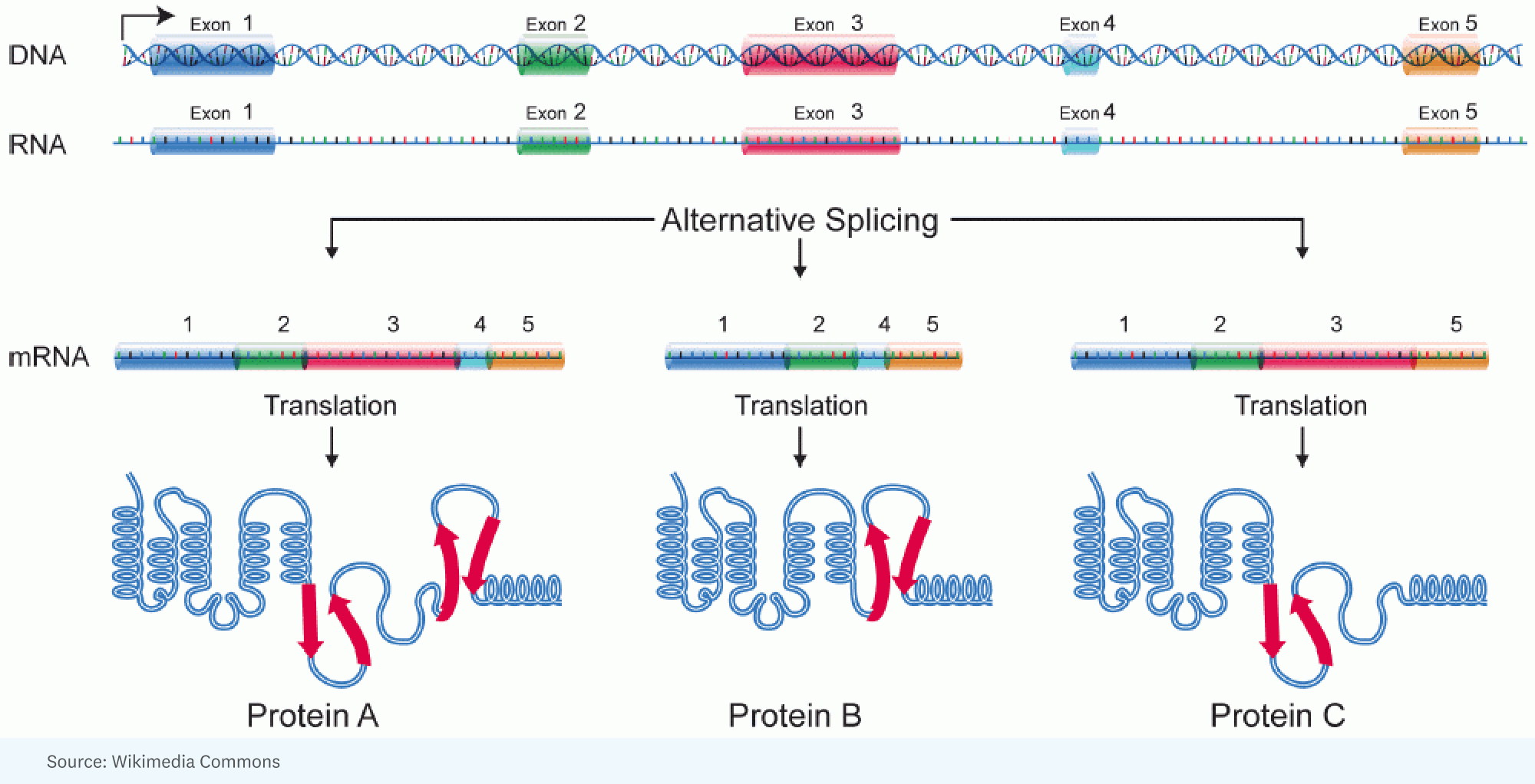
RICK: Karena sepanjang sejarah biologi, ada perdebatan tentang apa itu materi genetik, dan awalnya dianggap sebagai protein. Tapi begitu menjadi jelas bahwa protein adalah mesin dan DNA adalah cetak biru untuk mesin, orang sibuk dengan mesin karena cacat pada mesin menyebabkan penyakit. Tapi kemudian ternyata hanya 2% dari genom yang mengkode asam amino untuk protein. Sebagian besar, 98%, tidak. Dan pada tahun 2000, ketika para ilmuwan dari Proyek Genom Manusia disajikan urutan genom manusia, data itu menegaskan bahwa 98% dari 3.2 miliar basa kita tidak mengkodekan protein.
Setiap gen memiliki kemampuan luar biasa untuk mengambil potongan-potongan segmen protein yang akan dikodekan dan mengaturnya sehingga produk yang Anda dapatkan di satu sel mungkin bekerja sedikit lebih cepat, atau di sel lain mungkin benar-benar masuk ke sel yang berbeda. kompartemen untuk melakukan pekerjaan yang berbeda.
JORGE CONDE: Berapa perkiraan awal berapa banyak gen yang akan dikodekan dalam 3.2 miliar pasangan basa itu?
RICK: Kami menetapkan sekitar 100,000. Kami hanya berasumsi bahwa semakin kompleks kami, semakin besar genom, dan semakin banyak jumlah gen. Ada sedikit kejutan ketika kami menyadari bahwa kami dan serangga memiliki jumlah gen yang hampir sama.
JORGE: Lebih sedikit gen daripada yang kita perkirakan yang mengkode untuk apa yang kita anggap sebagai organisme yang sangat kompleks, bukan?
HANNE: Itu sedikit mengejutkan.
Kode sumber yang sama, program yang berbeda
JORGE: Satu hal yang kita semua pelajari di sekolah menengah adalah bahwa kode DNA untuk RNA, kode RNA untuk asam amino, dan asam amino memberi kita protein, bukan? Itulah dogma sentral dari biologi modern.
RIK: Ya. Salah satu alasan besar mengapa orang dengan cepat menyebut judul 'DNA sampah' untuk 98% genom yang tidak mengkode protein adalah karena diyakini, sebagian besar, bahwa tujuan bisnis genom adalah membuat protein.
JORGE: Jadi kapan ahli genetika mulai mendapatkan firasat bahwa DNA sampah mungkin lebih dari sampah?
RICK: [Ini dimulai dengan] kesadaran bahwa Anda dapat menjelaskan kompleksitas tambahan pada manusia versus serangga dengan sejumlah besar penyambungan alternatif. Di situlah Anda memiliki, untuk satu gen, RNA besar yang dibuat, tetapi disambungkan secara berbeda dalam satu sel versus sel lain. Dengan kata lain, bagian yang berbeda dari gen berakhir di molekul RNA yang akan menentukan protein. Jadi proteinnya sedikit berbeda.
HANNE: Kedengarannya seperti kaleidoskop sedikit dengan cahaya yang memukulnya secara berbeda, Anda mendapatkan warna yang berbeda, sudut yang berbeda.
RICK: Yah, dan itu analogi yang menarik. Saya pikir analogi yang lebih baik adalah ketika Anda memiliki Lego ini, dan Anda dapat membuat mesin, tetapi Anda dapat membuatnya dengan berbagai cara, begitu banyak struktur, warna yang berbeda. Setiap gen memiliki kemampuan luar biasa untuk mengambil potongan-potongan segmen protein yang akan dikodekan dan mengaturnya sehingga produk yang Anda dapatkan di satu sel mungkin bekerja sedikit lebih cepat, atau di sel lain mungkin benar-benar masuk ke sel yang berbeda. kompartemen untuk melakukan pekerjaan yang berbeda.
JORGE: Setiap sel pada manusia tertentu memiliki genom yang kira-kira sama. Namun genom yang sama memunculkan susunan yang sangat beragam dari jenis sel yang berbeda. Dan sejauh kita akan membuat analogi, setiap jenis sel menjalankan program yang berbeda dari kode sumber yang sama.
RIK: Itu benar.
Fungsi dari 98%
JORGE: Anda tidak perlu menjadi ahli untuk melihat jenis sel yang berbeda dan melihat betapa bervariasinya mereka, bukan? Sebuah neuron terlihat sangat, sangat, sangat berbeda dan berfungsi sangat, sangat berbeda dari, katakanlah, sel otot. Apa yang menentukan program, program genetik yang dipilih sel untuk dijalankan? Apa yang membuat sel otot menjadi sel otot, dan apa yang membuat neuron menjadi neuron?
RICK: Jadi kami mulai dengan DNA membuat RNA dan [RNA] membuat protein. Itulah dogma sentral. Tetapi sekitar setengah abad yang lalu, para ilmuwan mulai membuat argumen bahwa sebenarnya RNA mulai menciptakan berbagai macam fungsi dengan sendirinya. Dan ternyata RNA sebenarnya memiliki beberapa aktivitas pada tahap perkembangan paling awal.
Ketika sperma bertemu sel telur, RNA ibu yang dia masukkan ke dalam sel telur itu. Ada molekul RNA yang melakukan ini. Ternyata antibiotik yang kita gunakan secara rutin mengikat RNA. Jadi RNA memiliki beberapa peran yang cukup penting di sana. Itu mengubah cara orang berpikir. Kemudian, saat kami mulai berpikir tentang DNA sampah, itu adalah bagian dari DNA yang tidak mengkode protein. Nah, bagaimana jika dunia didasarkan pada RNA dan bukan protein, setidaknya di awal? Jadi sekarang kita mengerti bahwa sebagian besar dari apa yang kita sebut DNA sampah, atau yang biasa kita sebut DNA sampah, bukanlah sampah. Ini sangat fungsional. Dan sebagian besar membuat RNA.
Jadi, tujuan Anda dalam memprogram satu sel mana pun adalah menggunakan rangkaian urutan tertentu yang akan menyetel setiap rangkaian gen umum itu ke tingkat yang Anda inginkan. . . .Masalah kami adalah kami sebenarnya tidak tahu programnya.
HANNE: Wah. Bisakah Anda melakukan sedikit gambaran tentang tempat kita berada dalam memahami bagian DNA yang bukan pengkodean? Anda tahu, apa pemahaman kita saat ini tentang semua kemungkinan yang berbeda di sana?
RICK: Hanya 2% dari genom kita yang mengkode urutan asam amino yang masuk ke protein. Jadi apa yang ada di buku besar akuntan kami untuk apa yang dilakukan sisanya?
Sekitar setengah dari genom kita adalah apa yang kita sebut heterokromatin. Di situlah Anda mendapatkan produk dari invasi virus kuno. Retrovirus kuno menyerang, dan kemudian diubah menjadi DNA, dan dimasukkan ke dalam genom. Jadi itu sebenarnya adalah cara yang kita miliki sepanjang sejarah evolusi kita untuk menyembunyikan urutan yang tidak ingin kita tangani. Dan itu tetap diam dalam genom kita dengan pengecualian penting.
Setengah lainnya adalah tempat semua gen pengkode protein aktif, dan di mana semua gen noncoding aktif berada. Jadi apa fungsinya? Ini memiliki daftar panjang fungsi pengaturan, tetapi saya akan menyederhanakannya menjadi tiga.
Salah satu fungsinya adalah pemeliharaan kromosom. Nah, itulah tempat terjadinya replikasi DNA. Mereka adalah situs dalam genom kita yang bertanggung jawab untuk melipatnya karena merupakan polimer sepanjang 2 meter. Itu harus dilipat menjadi beberapa inti berdiameter mikron.
Wilayah regulasi kedua adalah semua hal yang bertanggung jawab untuk regulasi gen. Mungkin lebih banyak genom yang menentukan fitur regulasi untuk ekspresi gen daripada menentukan gen itu sendiri. Dan itu karena setiap sel menggunakan wilayah pengaturan yang berbeda untuk setiap gen.
HANNE: Sangat menarik, bagi saya kedengarannya seperti ada lemari dengan rak-rak di atasnya, barang-barang yang perlu kita taruh di lemari sebentar, dan kemudian ada lemari infrastruktur.
Mengapa penting untuk sangat fokus pada hal ini? Karena di situlah lebih dari 75% dari semua variasi genetik terkait penyakit terjadi.
RIK: Ya. Pada dasarnya, apa yang Anda miliki adalah seperangkat gen yang sama di setiap sel, baik pengkodean maupun bukan pengkodean. Dan Anda memiliki elemen, Anda memiliki urutan aktual yang hanya beroperasi di tipe sel tertentu. Jadi, tujuan Anda dalam memprogram satu sel mana pun adalah menggunakan rangkaian urutan tertentu yang akan menyetel setiap rangkaian gen umum itu ke tingkat yang Anda inginkan. Jadi Anda memainkan alat musik yang menakjubkan dari 20,000 gen pengkode protein, dan jumlah gen nonkode yang hampir sama. Anda melakukannya melalui urutan tertentu. Masalah kami adalah kami tidak benar-benar tahu programnya.
Menggoda program regulasi
HANNE: Jadi bagaimana Anda mulai memikirkannya? Petunjuk apa yang Anda ikuti ketika Anda mulai mencoba memahami program ini?
RICK: Petunjuknya adalah bahwa daerah pengatur untuk setiap gen dalam sel menampilkan dirinya sendiri. Mereka memberitahu Anda. Dan Anda dapat menggunakan berbagai teknologis yang sangat cepat memberitahu Anda di seluruh genom, dalam jenis sel tertentu, katakanlah di neuron motorik, apa saja daerah regulasi yang ada di dalam sel itu. Anda bahkan dapat melihat di mana rheostat diatur untuk masing-masing gen tersebut. Di situlah pengurutan cepat telah memberi kita kemampuan ini untuk secara bersamaan menyimpulkan semua elemen aktif untuk gen, baik pengkodean maupun nonpengkodean dalam genom tipe sel tertentu.
Masalah kami saat ini adalah Anda harus melakukan ini cukup banyak satu jenis sel pada satu waktu, dan kami memiliki banyak, ratusan jenis sel. Kadang-kadang sulit untuk benar-benar melihat sel tertentu tanpa mencemari sel lain, karena semua jaringan kita benar-benar merupakan kombinasi dari beberapa jenis sel.
JORGE: Apakah layak diperdebatkan dengan analogi jika kita mengatakan bahwa mengingat bahwa setiap sel memiliki seluruh genom, setiap sel memiliki seluruh buku nyanyian, jenis sel tertentu memilih untuk memainkan simfoni tertentu, dan mesin yang membantu mengatur genom pada dasarnya adalah konduktor orkestra? Mesin itu adalah konduktor yang menentukan lagu apa yang harus dimainkan, nada apa yang harus dipukul, pada volume berapa yang harus dipukul, pada tempo berapa, dll. Apakah itu analogi yang masuk akal untuk memahami fungsi pengaturan genom?
RICK: Dalam artian mudah untuk melihat seperti apa hasilnya. Tapi yang lebih menantang adalah, siapa yang menulis semua catatan itu? Siapa komposer yang menaruh semua catatan itu di sana, dan berhasil melakukannya? Komposernya ternyata, untuk sebagian besar sel kita dan sebagian besar gen kita, molekul protein ini disebut faktor transkripsi, yang tugasnya mengikat elemen pengatur gen, dan memberi mereka pengaturan rheostat.
Sekarang, ada kerutan yang menarik dalam hal ini karena di tempat-tempat di mana faktor-faktor transkripsi itu mengikat, kami menyebutnya sebagai penambah. Di situs penambah tersebut, selalu ada RNA yang dibuat dari situs tempat mereka terikat. Kami baru-baru ini memahami bahwa RNA memainkan peran penting dalam regulasi. Hanya untuk memperkuat itu: cara iPhone Anda mengenali wajah Anda adalah karena penambah yang mengontrol gen struktur wajah kranial berbeda-beda pada setiap manusia.
Apa yang Anda miliki sekarang di sini adalah tiga serangkai ini. Anda memiliki urutan DNA. Ini dikenali secara khusus oleh molekul penyusunnya, faktor transkripsi, tetapi ia membutuhkan bagian ketiga ini, molekul RNA ini. Jadi DNA, RNA, dan protein benar-benar bekerja sama di daerah pengatur tersebut. Dan mengapa sangat penting untuk fokus pada hal ini? Karena di situlah lebih dari 75% dari semua variasi genetik terkait penyakit terjadi.
HANNE: Tidak terlalu nerdy musik, tapi hampir terdengar seperti akord, kan? Struktur tiga nada semua bermain bersama untuk menciptakan sesuatu yang lebih besar.
RIK: Itu benar.
para programmer
JORGE: Salah satu bidang biologi yang paling mutakhir adalah peningkatan kemampuan kita untuk mencoba memahami beberapa hukum yang mengatur tentang bagaimana program sel ditentukan, bagaimana nasib sel ditentukan. Bagi saya salah satu lompatan maju yang menarik dalam pemahaman kita, datang dari pekerjaan yang Yamanaka lakukan, di mana dia dianugerahi penghargaan Penghargaan Nobel, menunjukkan bahwa Anda dapat memprogram ulang jenis sel hanya dengan memaparkan sel ke segelintir kecil faktor transkripsi spesifik.
HANNE: Bisakah Anda menjelaskan mengapa hal itu merupakan terobosan untuk bidang ini?
RICK: Saya memiliki sedikit peran dalam film itu. Ternyata meskipun itu jumlah yang sangat besar, sejumlah kecil faktor transkripsi dapat mengidentifikasi semua elemen pengatur yang penting untuk identitas sel itu. Dan Yamanaka membuktikan ini kepada kami dengan menunjukkan bahwa hanya empat dari faktor-faktor ini yang dapat digunakan untuk memprogram sel manusia mana pun, atau sel pria mana pun menjadi setara dengan sel induk embrionik.
Salah satu cara untuk memikirkan hal ini adalah, jika lagunya terlalu buruk, organisme itu tidak akan hidup. Tetapi jika hanya sedikit, Anda tumbuh dewasa, Anda menjadi dewasa, dan kemudian Anda mendapatkan semua penyakit yang berbeda ini seiring bertambahnya usia.
JORGE: Dan itu luar biasa, bukan? Karena itu akan menunjukkan bahwa sistem itu entah bagaimana dirancang di mana kompleksitas luar biasa diambil dari apa yang terdengar seperti kesederhanaan. Empat faktor transkripsi menentukan semua rangkaian peristiwa kompleks yang mengatur berbagai jenis sel.
Beberapa pekerjaan yang telah Anda lakukan telah menunjukkan bahwa faktor-faktor transkripsi utama ini pada dasarnya mengatur ekuivalen sirkuit yang mengontrol gen yang diperlukan sel untuk membangun dan mempertahankan keadaannya. Dapatkah Anda menjelaskan apa yang Anda maksud dengan sirkuit kontrol gen?
RICK: Ada dua elemen keren pada sirkuit kontrol gen. Salah satunya adalah, ketika master regulator menemukan penambah ini dan menyebabkan ekspresi gen targetnya, itu adalah bagian dari sirkuit, itulah outputnya. Elemen lain yang sangat keren adalah bahwa faktor transkripsi master juga mengatur ekspresinya sendiri. Jadi ada umpan balik. Seperti, Anda akan memiliki diagram listrik di mana Anda memiliki master yang mengendalikan ekspresi mereka sendiri dari gen mereka sendiri, dan kemudian mengikat dan mengendalikan ekspresi satu set gen target.
JORGE: Itu cukup liar. Ini hampir seperti referensi melingkar, di mana faktor transkripsi adalah protein, protein itu dibuat dari DNA, dikodekan dalam gen. Faktor transkripsi adalah bagian dari mesin yang membantu ekspresi dalam transkripsi gen. Oleh karena itu, Anda mengatakan faktor transkripsi–protein–membantu mengatur ekspresi gen yang membuat faktor transkripsi.
HANNE: Ya. Ada gambaran mental dari seluruh simfoni dari semua sel kecil ini, Anda tahu, menyanyikan semua tekstur yang berbeda ini.
Genom pengatur dan penyakit
HANNE: Apa yang berubah ketika kita mulai memahami bagaimana semua ini berfungsi? Apa yang bisa kita lakukan dengan pengetahuan ini?
RICK: Situs-situs di mana faktor transkripsi utama ini mendorong identitas setiap sel adalah tempat sebagian besar variasi manusia yang menyebabkan penyakit. Lebih dari 75% variasi terkait penyakit terjadi pada elemen penambah ini yang menggerakkan gen kunci.
JORGE: Oke. Jadi itu liar, kan? Ketika kita berpikir tentang mutasi yang menyebabkan atau berkontribusi terhadap penyakit, kita biasanya berpikir tentang mutasi yang terjadi di dalam gen yang mempengaruhi protein, entah bagaimana memecah protein, dan yang menimbulkan penyakit.
HANNE: Benar.
JORGE: Tetapi Anda mengatakan bahwa dalam 75% kasus, mutasi itu sebenarnya terjadi di luar gen, itu terjadi di wilayah genom yang bukan pengkodean ini. Jika gennya adalah lagunya, bukan karena lagunya salah diputar, mungkin dimainkan terlalu keras, atau terlalu lembut, atau terlalu lambat, atau terlalu cepat, tetapi itulah yang mendorong banyak penyakit.
RICK: Sebenarnya, salah satu cara untuk memikirkan hal ini adalah, jika lagunya terlalu buruk, organisme tidak akan hidup. Tetapi jika hanya sedikit, Anda tumbuh dewasa, Anda menjadi dewasa, dan kemudian Anda mendapatkan semua penyakit yang berbeda ini seiring bertambahnya usia.
Untuk pertama kalinya, kami memiliki semua model ini tentang cara Anda mengatur peralatan dan membuatnya bekerja.
JORGE: Bukan membuat versi gen yang salah, tetapi mendapatkan dosis gen yang salah. Terlalu banyak atau terlalu sedikit.
RIK: Itu benar. Bagaimana Anda menemukan terapi yang menangani hal ini? Bagaimana Anda secara selektif menyetel atau menyetel ke bawah gen? Pada prinsipnya, kita bisa melakukannya dengan banyak cara, dan kita bisa melakukannya dengan terapi gen. Kita dapat melakukannya dengan pengeditan gen CRISPR. Tetapi hal terpenting yang menurut saya telah kita temukan dalam beberapa tahun terakhir adalah bahwa setiap elemen pengatur gen ini memiliki RNA. RNA berfungsi. Ini adalah rheostat yang membantu menyetel output gen itu. Sekarang ada banyak cara yang bisa kamu lakukan RNA obat. Kita punya ASO (oligonukleotida antisense), seperti Spinraza untuk atrofi otot tulang belakang. Kami mendapat gangguan RNA. Kami punya beberapa obat molekul kecil baru di cakrawala. Jika Anda dapat memikirkan cara memprogram obat, RNA sintetis, untuk mengatur RNA pengatur, RNA pengatur, Anda memiliki cara utama untuk menyetel satu gen di sel mana pun di mana sel itu dapat memperoleh akses ke obat itu.
HANNE: Jadi bukan hanya pemahaman yang berbeda tentang bagaimana penyakit muncul. Tapi itu pemahaman yang sangat berbeda tentang bagaimana kita berpotensi mengobati penyakit.
RIK: Tepat sekali. Pada prinsipnya, kami sekarang memiliki cara yang dapat diprogram untuk mengembangkan obat yang menyesuaikan satu gen yang diinginkan. Pada saat ini, orang hanya memprogram molekul RNA sintetis untuk menghasilkan vaksin untuk pandemi ini. Salah satu hasil yang sebaik yang Anda harapkan untuk vaksin.
JORGE: Ketika kita berpikir tentang aplikasi dari teknologi dalam biologi, kami biasanya mencoba melakukan salah satu dari dua hal. Kami mencoba untuk menginterogasi biologi secara mendalam, dan memahaminya, meningkatkan tingkat kerumitannya, atau kami mencoba untuk campur tangan. Kami semakin mampu menginterogasi biologi pada tingkat yang sangat, sangat dalam sehingga kami memahami hukum yang mengatur atau aturan tentang bagaimana sel diatur. Dan kami memilikinya, kami memiliki alat yang semakin canggih, seperti ini modalitas obat yang dapat diprogram, di mana kita dapat menargetkan RNA, sangat, sangat spesifik. Ini akan menjadi semacam siklus yang baik antara kemampuan kita untuk menginterogasi biologi dan kemudian campur tangan dengan cara yang semakin canggih. Dan saya pikir itu salah satu aspek yang paling menarik di mana kita menemukan diri kita hari ini di bidang ini.
RIK: Saya setuju dengan Anda. Kami sekarang sedang mengembangkan pemahaman yang mendalam tentang berbagai lapisan kompleksitas, sehingga kami dapat menghasilkan hipotesis terapeutik yang belum pernah kami lihat sebelumnya. Kami dapat melakukannya dengan kecepatan yang tidak pernah kami bayangkan beberapa tahun lalu. Jarak temporal antara penemuan dasar dan terapi yang diberikan kepada orang-orang 10 tahun yang lalu adalah rata-rata 14 tahun. Sekarang, bisa dibayangkan untuk mengembangkan hipotesis terapi berdasarkan ilmu dasar, dan terapi yang mencapai pasien dalam sembilan bulan. Kami adalah melihat itu dengan vaksin baru ini.
HANNE: Jadi, mengubah tidak hanya bagaimana kita memahami penyakit yang muncul, bagaimana kita mengobatinya, tetapi juga bagaimana kita melakukan sains itu sendiri, dan kemudian seberapa cepat sains itu bisa terjadi dan berubah menjadi realitas klinis bagi pasien.
RNA sebagai kompartementalisasi
RIK: Tepat sekali. Tapi sekarang ada lapisan gula pada kue karena, secara klasik, kami telah memikirkan farmakologi dalam dua cara. Salah satunya adalah efek obat pada individu. Yang lainnya adalah efek individu pada obat. Dan di segmen terakhir ini, Anda khawatir tentang distribusi obat, jaringan apa yang digunakan, jaringan apa yang tidak tersedia. Karena kita hanya berasumsi begitu obat masuk ke dalam sel, obat itu berdifusi melalui sel dan menemukan targetnya. Kami memiliki kompartemen yang terikat membran, yang telah kami ketahui selama satu abad.
JORGE: Yang selalu menjadi pertanyaan tentang permeabilitas sel, kan? Bisakah itu melewati membran?
RIK: Ya. Bisakah itu melintasi membran, dan apakah itu masuk ke nukleus atau tidak? Tetapi kami baru memahami dalam dekade terakhir bahwa ada juga banyak badan non-membran dalam sel yang disebut kondensat biomolekuler karena diperkirakan salah satu alasan terbentuknya benda-benda ini adalah mereka mengembun seperti air yang mengembun menjadi titik embun. Tapi apa yang telah begitu mendalam tentang pemahaman ini adalah bahwa kondensat ini mengkotak-kotakkan protein, DNA, RNA untuk fungsi tertentu. Dan sekarang kami telah memahami bahwa Anda dapat memisahkan 5 hingga 10 miliar molekul protein dan RNA dalam sel ke dalam berbagai kompartemen tempat mereka berfungsi bersama teman-temannya.
HANNE: Hah.
JORGE: Apakah kita meninggalkan ranah biologi dan memasuki ranah fisika?
RICK: Kami telah melakukan hal itu karena pemisahan fase dianggap sebagai kekuatan pendorong. Itu adalah fenomena fisik yang dijelaskan oleh matematika.
HANNE: Wah.
RICK: Sekarang, kami telah mempelajari obat kemoterapi yang paling efektif adalah berkonsentrasi di dalam kompartemen tempat target mereka tinggal. Mereka berkonsentrasi 600 kali lipat di seluruh sel, sehingga mereka memiliki aktivitas on-target onkogen yang 600 kali lipat dari yang kami harapkan. Ini tidak hanya memberi tahu kita bahwa ada wawasan baru yang penting dalam penemuan dan pengembangan obat untuk masa depan, tetapi juga membuat kita ingin lebih memahami apa yang dilakukan kondensat ini.
Inilah yang saya maksud dengan lapisan gula pada kue. Apa yang kami sadari adalah bahwa kompartemen kondensat yang memfungsikan sel sedemikian penting diatur oleh RNA. Pembentukan mereka dapat dirangsang oleh RNA. Jika Anda menghasilkan terlalu banyak RNA, Anda membawa rheostat hingga 11, itu akan melarutkan kondensat. Jadi, tiba-tiba, kami menyadari bahwa keluaran RNA di situs mana pun di dalam sel dapat menyesuaikan fungsi apa pun dengan meningkatkan atau melarutkan kondensat tempat fungsi itu terjadi. Dan itu, saya pikir, mendalam karena ini adalah cara lain RNA yang dapat diprogram, molekul RNA sintetis, dapat digunakan untuk menyesuaikan fungsi sel yang menjadi tidak berfungsi. Untuk pertama kalinya, kami memiliki semua model ini tentang cara Anda mengatur peralatan dan membuatnya bekerja.
HANNE: Kenop lain untuk memutar.
RICK: Tapi bagaimana cara mematikannya? Ternyata ketika Anda membuat RNA panjang itu, itu hanya serangkaian besar muatan negatif, dan itu melarutkan kondensat dan mematikan gen. Begitulah cara gen diatur. Anda menyetel kondensat dengan RNA, lalu Anda mematikannya dengan produk RNA yang dibuat saat gen ditranskripsikan sepenuhnya.
HANNE: Sangat keren. Jadi saklar mati dan hidup, sungguh.
RICK: Ini adalah sakelar mati/hidup yang tidak diantisipasi oleh siapa pun. Dan itu berarti, sekali lagi, jika Anda memiliki obat yang dapat diprogram, Anda memiliki cara baru untuk menargetkan fungsi seluler yang tidak berfungsi, solusi baru untuk masalah terapeutik.
JORGE: DNA sampah satu orang adalah mesin pengatur genom canggih milik orang lain.
HANNE: Atau setiap pria.
Diposting 15 Juli 2022
Teknologi, inovasi, dan masa depan, seperti yang diceritakan oleh mereka yang membangunnya.
- Andreessen Horowitz
- Bio & Sains
- Bitcoin
- blockchain
- kepatuhan blockchain
- konferensi blockchain
- coinbase
- kecerdasan
- Konsensus
- konferensi crypto
- pertambangan kripto
- cryptocurrency
- Terdesentralisasi
- Defi
- Aset-Aset Digital
- ethereum
- Mesin belajar
- token yang tidak dapat dipertukarkan
- plato
- plato ai
- Kecerdasan Data Plato
- Platoblockchain
- Data Plato
- permainan plato
- Poligon
- bukti kepemilikan
- W3
- zephyrnet.dll