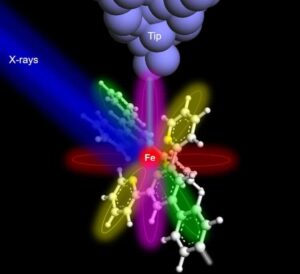
La rodopsina, la proteina che consente agli esseri umani e ad altri vertebrati di percepire la luce, appartiene alla famiglia dei recettori accoppiati a proteine G sensibili alla luce (GPCR). Viene prima nel percorso di trasduzione del segnale per iniziare la visione. Una volta assorbito un fotone, si verifica un cambiamento conformazionale immediato (entro 200 fs) nella retina, un cromoforo situato all'interno della rodopsina. Questo primo cambiamento strutturale avvia i processi di trasduzione del segnale cellulare che determinano le prime fasi della visione. Tuttavia, i dettagli degli eventi intramolecolari in tempo reale attraverso i quali la retina fotoattivata induce gli eventi di attivazione all'interno della rodopsina rimangono poco chiari.
Per colmare questa lacuna di conoscenza, i ricercatori del Istituto Paul Scherrer (PSI) in Svizzera ha utilizzato la cristallografia a risoluzione temporale ultraveloce per studiare i cambiamenti conformazionali nella rodopsina dopo che ha assorbito un fotone. Le loro scoperte, riportate in Natura, spiegare come la retina assorba solo una parte dell'energia del fotone, immagazzinando l'energia rimanente per alimentare i cambiamenti conformazionali associati alla formazione dello stato di segnalazione di legame alla proteina G.
Per registrare e analizzare il meccanismo di attivazione del cromoforo retinico su scala atomica e con una risoluzione temporale ultraveloce (picosecondi), il team ha utilizzato la cristallografia seriale a femtosecondi risolta nel tempo (TR-SFX) a temperatura ambiente.
Per i loro esperimenti, i ricercatori hanno prima coltivato microcristalli di rodopsina di alta qualità, quindi hanno utilizzato TR-SFX per generare una serie di immagini del modello di diffrazione dei cristalli. Più precisamente, hanno usato un impulso laser ottico per fotoattivare le molecole proteiche nel cristallo e poi, dopo un ritardo di tempo specificato, hanno sondato la struttura con un impulso a raggi X da un laser a elettroni liberi a raggi X (XFEL). Registrando con l'XFEL, effettivamente una fotocamera ad altissima velocità, i ricercatori hanno raccolto fotogrammi seriali da decine di migliaia di cristalli orientati in modo casuale.

Le analisi eseguite dal team includevano la modellizzazione della struttura della rodopsina per i cambiamenti della densità elettronica insieme al perfezionamento strutturale rispetto alle osservazioni cristallografiche. Ciò ha rivelato che l'isomerizzazione indotta dalla luce (in cui una molecola passa tra due conformazioni distinte) con una curva nel cromoforo retinico persiste per 1 ps, dato che il primo intermedio metastabile della rodopsina appare 200 fs dopo la fotoattivazione. Quindi, 100 ps dopo, la struttura della rodopsina adotta una conformazione più rilassata. Pertanto i risultati suggeriscono che la proteina utilizza zone attive (o funzionali) dei percorsi strutturali GPCR per la dissipazione dell'energia.

Collegamento dei punti per ripristinare artificialmente la vista
Uno dei punti salienti di questo nuovo studio è che la struttura a temperatura ambiente rivela la densità elettronica per tutte le molecole d'acqua funzionali e strutturali precedentemente descritte, comprese quelle che hanno un ruolo successivo nel processo di fotoattivazione. I ricercatori osservano che le strutture precedenti risolte in condizioni criogeniche non sono riuscite a raggiungere questo obiettivo. Di conseguenza, la nuova struttura SFX ad alta risoluzione della rodopsina mette in mostra l'intera rete di legami idrogeno mediata dall'acqua all'interno della proteina.
L'indagine fa luce sulle prime fasi della visione, rivelando che la dissipazione ultraveloce di energia nella rodopsina avviene attraverso residui conservati delle vie di attivazione dei GPCR, aprendo la strada allo studio dei primi eventi di attivazione in questa più grande famiglia di GPCR (classe A).
- Distribuzione di contenuti basati su SEO e PR. Ricevi amplificazione oggi.
- PlatoAiStream. Intelligenza dei dati Web3. Conoscenza amplificata. Accedi qui.
- Coniare il futuro con Adryenn Ashley. Accedi qui.
- Acquista e vendi azioni in società PRE-IPO con PREIPO®. Accedi qui.
- Fonte: https://physicsworld.com/a/ultrafast-imaging-sheds-light-on-the-earliest-stages-of-vision/
- :È
- 1
- 100
- 200
- a
- sopra
- Raggiungere
- Attivazione
- attivo
- Dopo shavasana, sedersi in silenzio; saluti;
- contro
- Tutti
- an
- analizzare
- Analisi
- ed
- appare
- SONO
- associato
- At
- iniziare
- appartiene
- fra
- biologia
- legame
- by
- stanza
- il cambiamento
- Modifiche
- chimica
- classe
- clicca
- colleghi
- viene
- condizioni
- conseguentemente
- Cristallo
- ritardo
- descritta
- dettagli
- Diego
- distinto
- Divisione
- Presto
- in maniera efficace
- Abilita
- energia
- interezza
- eventi
- esperimenti
- Spiegare
- fallito
- famiglia
- riempire
- I risultati
- Nome
- Nel
- formazione
- Gratis
- da
- FS
- Carburante
- funzionale
- divario
- generare
- dato
- Avere
- capo
- alta qualità
- ad alta risoluzione
- Highlight
- Come
- Tuttavia
- HTTPS
- Gli esseri umani
- Idrogenazione
- Immagine
- immagini
- Imaging
- immediato
- in
- incluso
- Compreso
- informazioni
- iniziati
- indagine
- problema
- IT
- SUO
- jpg
- conoscenze
- maggiore
- laser
- dopo
- leggera
- collocato
- modo
- max-width
- meccanismo
- metastabile
- modellismo
- molecola
- Scopri di più
- Natura
- Rete
- New
- of
- on
- una volta
- esclusivamente
- aprire
- or
- Altro
- parte
- Cartamodello
- Pavimentazione
- persiste
- fotografia
- Fisica
- Mondo della fisica
- Platone
- Platone Data Intelligence
- PlatoneDati
- precisamente
- precedente
- in precedenza
- processi
- i processi
- Proteine
- impulso
- casuale
- tempo reale
- record
- registrazione
- rimanere
- rimanente
- Segnalati
- riparazioni
- ricercatore
- ricercatori
- Risoluzione
- risoluto
- ripristinare
- Risultati
- Rivelato
- rivelando
- Rivela
- Ruolo
- Prenotazione sale
- s
- Scala
- senso
- serial
- Serie
- set
- Forma
- Capannoni
- mostrato
- Signal
- specificato
- tappe
- Regione / Stato
- memorizzare
- strutturale
- La struttura
- Studio
- suggerire
- Svizzera
- team
- decine
- che
- Il
- loro
- poi
- in tal modo
- di
- questo
- quelli
- migliaia
- Attraverso
- miniature
- tempo
- a
- insieme
- vero
- seconda
- per
- utilizzato
- utilizza
- molto
- visione
- Water
- Modo..
- quale
- con
- entro
- mondo
- raggi X
- zefiro
- zone