Trattare il cancro con le radiazioni può stimolare la risposta immunitaria dell’organismo e inibire la crescita del tumore, ma può anche ridurre il livello dei linfociti, i globuli bianchi associati alla risposta immunitaria, con conseguente compromissione del controllo del tumore e prognosi sfavorevole. La gravità di questa linfopenia indotta da radiazioni è correlata alla dose erogata alle cellule del sangue e ai linfociti circolanti. Pertanto, ridurre al minimo la dose al cuore, al sangue periferico e agli organi linfoidi potrebbe aiutare a ridurre questo effetto dannoso.
Per indagare ulteriormente questa teoria, Antje Galts e Abdelkhalek Hammi dell’Università TU di Dortmund hanno esplorato se la radioterapia FLASH – radiazioni erogate a dosi ultra elevate – potrebbe ridurre il livello di deplezione delle cellule immunitarie durante la terapia protonica dei pazienti affetti da cancro al cervello.
“Il meccanismo biologico alla base dell’effetto di risparmio FLASH osservato a dosi elevate non è ancora del tutto compreso. Tuttavia, una delle teorie proposte è l’ipotesi immunitaria, che suggerisce che la somministrazione di una dose istantanea di irradiazione FLASH riduce significativamente l’esaurimento dei linfociti circolanti minimizzando il tempo di esposizione”, spiega Hammi. “Nel nostro studio, abbiamo dimostrato che un trattamento ipofrazionato e una somministrazione rapida della dose hanno risparmiato le cellule immunitarie fino a 27 volte rispetto a un piano di trattamento convenzionale con scansione a fascio di protoni frazionato”.
Galts e Hammi usarono un file modello dosimetrico del flusso sanguigno per simulare la dose ai linfociti circolanti durante la terapia protonica ad intensità modulata (IMPT) convenzionale e basata su FLASH di un tumore al cervello. Il modello di erogazione del fascio dinamico simula un piano di trattamento frazionato IMPT considerando la variazione spaziotemporale del dosaggio di ogni singolo fascio di protoni. Hammi osserva che il modello incorpora parametri di erogazione realistici dei ciclotroni disponibili in commercio.
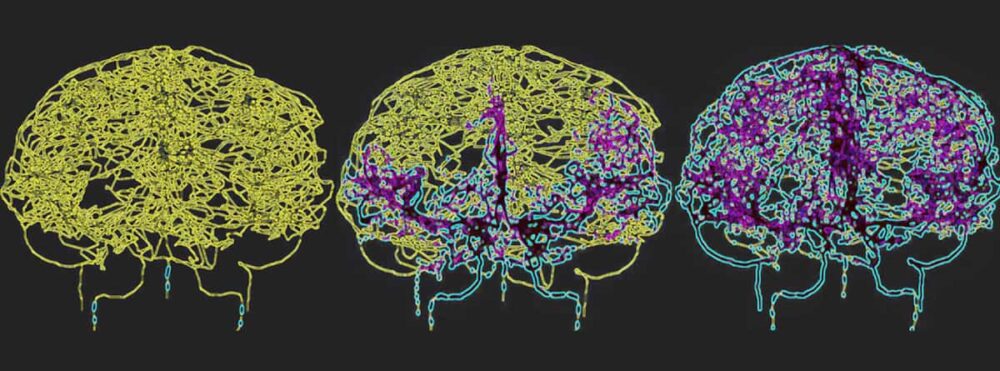
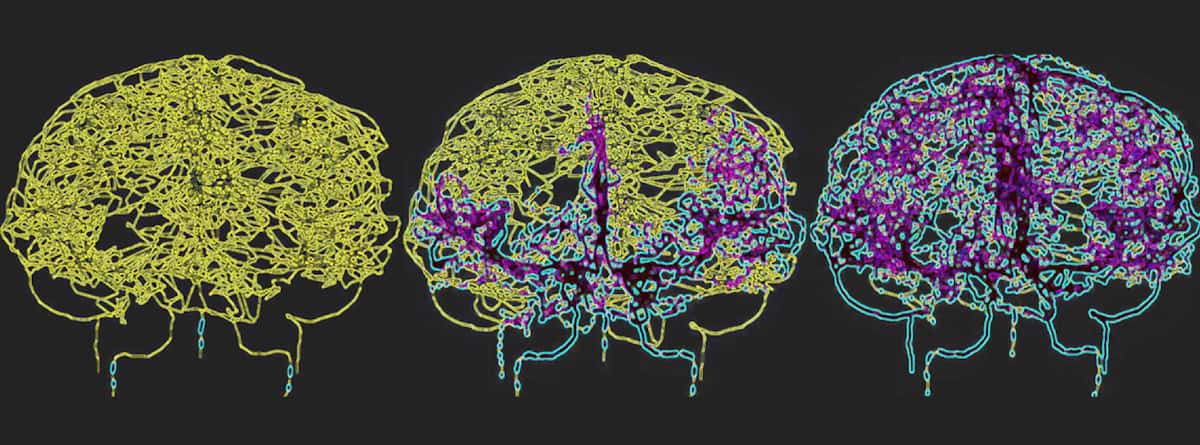
Per riflettere accuratamente la circolazione del sangue nel cervello umano, Galts e Hammi hanno mappato i vasi sanguigni direttamente dalle immagini dell’angiografia RM cerebrale. Hanno utilizzato il modello cerebrovascolare risultante, che comprendeva 465 vasi sanguigni e 8841 rami vascolari individuali, per simulare la circolazione delle cellule immunitarie all’interno del flusso sanguigno.
I ricercatori hanno creato piani di trattamento IMPT realistici per un tumore glioblastoma, utilizzando quattro fasci di protoni incidenti e parametri di erogazione clinicamente rilevanti. Hanno quindi calcolato i campi di radiazioni variabili nel tempo a cui è esposto il sangue circolante durante l'erogazione dei piani di terapia protonica e la dose accumulata dopo il trattamento, riportando i risultati in Fisica in Medicina e Biologia.
Il glioblastoma è la forma più letale di cancro al cervello e il trattamento con la radioterapia può causare una linfopenia prolungata indotta dalle radiazioni. “Modellando un sistema cerebrovascolare durante la somministrazione di radiazioni, speriamo di ottenere informazioni più approfondite su come la radioterapia influenza la risposta immunitaria in questi gruppi di pazienti, portando potenzialmente a strategie terapeutiche migliorate”, afferma Hammi.
Pianifica i confronti
Galts e Hammi hanno esaminato quattro scenari di trattamento: IMPT FLASH con una singola frazione da 22.3 Gy; FLASH ipofrazionato utilizzando due frazioni da 14.6 Gy e cinque da 8 Gy; e IMPT convenzionale utilizzando trentadue frazioni da 2 Gy. Per ciascun piano di trattamento è stato valutato l’impatto dosimetrico sui linfociti circolanti e stimata la conseguente radiotossicità.
Gli istogrammi dose-volume hanno rivelato che la radioterapia FLASH ha ridotto significativamente la proporzione di cellule irradiate rispetto al dosaggio convenzionale IMPT. Durante la prima frazione di trattamento, tutti e tre gli schemi FLASH hanno irradiato circa l'1.52% del volume sanguigno circolante, mentre l'IMPT convenzionale ha irradiato il 2.18%. I piani FLASH ipofrazionati, somministrati in due o cinque frazioni, hanno aumentato il volume irradiato rispettivamente al 3.01% e al 7.35%, mentre l'IMPT convenzionale ha esposto alle radiazioni il 42.41% del sangue periferico.
Successivamente, i ricercatori hanno esaminato il livello dei linfociti circolanti che hanno ricevuto una dose di almeno 7 cGy – una soglia che causa una deplezione del 2% nella popolazione linfocitaria – durante l’intero trattamento. Dopo aver completato l’IMPT convenzionale, il 25.65% dei linfociti circolanti ha ricevuto una dose di almeno 7 cGy. Per i trattamenti FLASH a singola, due e cinque frazioni, i volumi che hanno ricevuto più di questa soglia di dose sono stati rispettivamente 1.21%, 2.30% e 5.14%.
I volumi di linfociti circolanti che hanno ricevuto dosi superiori a 100 cGy, che causano una deplezione del 30%, erano 0.77%, 1.28% e 2.09% rispettivamente per FLASH a singola, due e cinque frazioni e 0.10% durante IMPT convenzionale.
Galts e Hammi hanno studiato anche la risposta dei linfociti CD4+ e CD8+, che hanno distribuzioni diverse nel sangue periferico, ai diversi scenari di irradiazione. Per entrambi i tipi di linfociti, l'uccisione cellulare dopo la prima frazione è stata dello 0.66%, 0.62%, 0.32% e 0.08% rispettivamente per FLASH a singola, due e cinque frazioni e IMPT convenzionale.
Il modello computazionale determina la dose al sangue durante la radioterapia
Dopo il trattamento completo, la deplezione dei linfociti è stata rispettivamente dell'1.02% e dell'1.56% per le frazioni a due e cinque trattamenti e del 2.14% per l'IMPT convenzionale. Questi risultati dimostrano che la terapia protonica FLASH risparmia le cellule immunitarie circolanti durante il trattamento intracranico, con FLASH a frazione singola che riduce il tasso di deplezione di quasi il 70% rispetto all’IMPT convenzionale.
Hammi racconta Mondo della fisica che ora stanno espandendo il modello per includere i tumori della testa e del collo. "Inoltre, stiamo esplorando vari metodi di somministrazione FLASH e il loro impatto sull'esaurimento del sistema immunitario, con particolare attenzione al trattamento FLASH conformazionale basato sulla modulazione energetica passiva e specifica per il paziente", spiega. "Questo modello di consegna ha il potenziale per risparmiare più linfociti circolanti rispetto alla consegna FLASH shoot-through."
- Distribuzione di contenuti basati su SEO e PR. Ricevi amplificazione oggi.
- PlatoData.Network Generativo verticale Ai. Potenzia te stesso. Accedi qui.
- PlatoAiStream. Intelligenza Web3. Conoscenza amplificata. Accedi qui.
- PlatoneESG. Carbonio, Tecnologia pulita, Energia, Ambiente, Solare, Gestione dei rifiuti. Accedi qui.
- Platone Salute. Intelligence sulle biotecnologie e sulle sperimentazioni cliniche. Accedi qui.
- Fonte: https://physicsworld.com/a/flash-irradiation-spares-immune-cells-during-proton-therapy/
- :ha
- :È
- :non
- $ SU
- 1
- 10
- 100
- 14
- 160
- 2%
- 22
- 25
- 27
- 35%
- 7
- 8
- a
- Accumulato
- con precisione
- Dopo shavasana, sedersi in silenzio; saluti;
- Tutti
- quasi
- anche
- an
- ed
- SONO
- in giro
- AS
- valutato
- associato
- At
- disponibile
- basato
- Larghezza
- dietro
- sangue
- entrambi
- Cervello
- cancro al cervello
- rami
- ma
- by
- calcolato
- Materiale
- Cancro
- Causare
- cause
- cella
- Celle
- circolante
- Circolazione
- clicca
- commercialmente
- rispetto
- completando
- considerando
- di controllo
- convenzionale
- potuto
- creato
- più profondo
- consegnato
- consegna
- dimostrare
- determina
- diverso
- direttamente
- distribuzione
- distribuzioni
- dose
- dosi
- durante
- dinamico
- ogni
- effetto
- energia
- Intero
- pari
- equilibrio
- stimato
- espansione
- Spiega
- Esplorazione
- Esplorare
- esposto
- Esposizione
- FAST
- campi
- I risultati
- Nome
- cinque
- Cromatografia
- flusso
- Focus
- i seguenti
- Nel
- modulo
- quattro
- frazione
- da
- pieno
- completamente
- ulteriormente
- Guadagno
- Gruppo
- Crescita
- Avere
- he
- Cuore
- Aiuto
- Alta
- speranza
- Come
- Tuttavia
- HTTPS
- umano
- Immagine
- immagini
- Sistema immunitario
- Impact
- migliorata
- IMPTO
- in
- incidente
- includere
- incluso
- incorpora
- è aumentato
- individuale
- informazioni
- intuizioni
- ai miglioramenti
- indagare
- problema
- IT
- jpg
- uccisione
- principale
- meno
- a sinistra
- Livello
- più a lungo
- max-width
- meccanismo
- medicina
- metodi
- minimizzando
- modello
- modellismo
- modellismo
- Scopri di più
- maggior parte
- mr
- Note
- adesso
- of
- on
- ONE
- aprire
- or
- nostro
- su
- ancora
- parametri
- particolare
- passivo
- pazienti
- Fisica
- Mondo della fisica
- piano
- piani
- Platone
- Platone Data Intelligence
- PlatoneDati
- povero
- popolazione
- potenziale
- potenzialmente
- proporzione
- proposto
- Radioterapia
- tasso
- realistico
- ricevuto
- ricevente
- ridurre
- Ridotto
- riduce
- riducendo
- riflettere
- pertinente
- Reportistica
- ricercatori
- rispettivamente
- risposta
- risultante
- Rivelato
- destra
- s
- dice
- scansione
- Scenari
- schemi
- ha mostrato
- significativamente
- singolo
- inizia a
- stimolare
- strategie
- ruscello
- studiato
- Studio
- tale
- suggerisce
- sistema
- dice
- di
- che
- Il
- loro
- poi
- teoria
- terapia
- Strumenti Bowman per analizzare le seguenti finiture:
- di
- questo
- tre
- soglia
- Attraverso
- miniature
- tempo
- volte
- a
- trattare
- trattamento
- trattamenti
- vero
- seconda
- Tipi di
- inteso
- Università
- utilizzato
- utilizzando
- vario
- Nave
- volume
- volumi
- Prima
- we
- sono stati
- quando
- se
- quale
- while
- bianca
- con
- entro
- mondo
- ancora
- zefiro