Un nuovo tipo di modello computerizzato in grado di rivelare i danni da radiazioni a livello cellulare potrebbe migliorare i risultati della radioterapia per i pazienti affetti da cancro ai polmoni.
Romano Bauer, un neuroscienziato computazionale presso il Università di Surrey nel Regno Unito, in collaborazione con Marco Durante ed Nicolò Cogno da GSI Helmholtzzentrum für Schwerionenforschung in Germania, ha creato il modello, che simula il modo in cui le radiazioni interagiscono con i polmoni cellula per cellula.
Oltre la metà di tutti i pazienti affetti da cancro ai polmoni vengono trattati con la radioterapia. Sebbene questo approccio sia efficace, lascia fino al 30% dei riceventi con lesioni indotte dalle radiazioni. Questi possono innescare condizioni gravi che influenzano la respirazione, come la fibrosi – in cui il rivestimento degli alveoli (sacche d’aria) nei polmoni è ispessito e irrigidito – e la polmonite – quando le pareti degli alveoli si infiammano.
Al fine di limitare i danni da radiazioni ai tessuti sani uccidendo allo stesso tempo le cellule tumorali, la radioterapia viene somministrata in diverse “frazioni” separate. Ciò consente di somministrare una dose complessiva più elevata, e quindi più efficace, poiché alcune cellule sane danneggiate possono ripararsi tra una frazione e l’altra.
Attualmente, gli schemi di frazionamento della radioterapia vengono scelti sulla base dell’esperienza passata e di modelli statistici generalizzati, quindi non sono ottimizzati per i singoli pazienti. La medicina personalizzata, invece, potrà realizzarsi grazie a questo nuovo modello che, come spiega Durante, direttore dell' Dipartimento di Biofisica del GSI spiega, esamina “la tossicità nei tessuti partendo dalle reazioni cellulari di base ed è quindi in grado di prevedere cosa succede a qualsiasi paziente” quando vengono scelti diversi schemi di frazionamento.
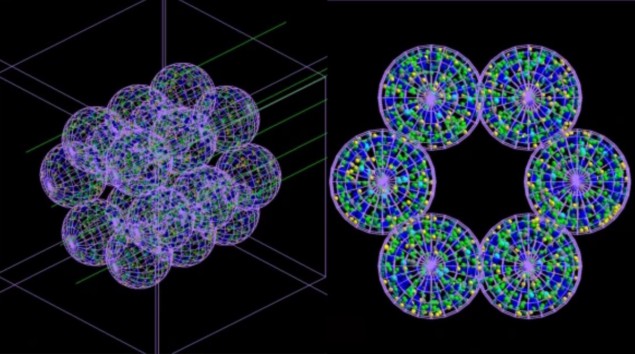
Il team ha sviluppato un modello “basato su agenti” (ABM) costituito da unità o agenti interagenti separati – che in questo caso imitano le cellule polmonari – accoppiati con un simulatore Monte Carlo. L'ABM, descritto in Medicina delle comunicazioni, costruisce una rappresentazione di un segmento alveolare costituito da 18 alveoli ciascuno di 260 µm di diametro. Successivamente, vengono eseguite simulazioni Monte Carlo dell'irradiazione di questi alveoli su scala microscopica e nanoscopica e le informazioni sulla dose di radiazioni erogata a ciascuna cellula e sulla sua distribuzione vengono reimmesse nell'ABM.
L'ABM utilizza queste informazioni per capire se ciascuna cellula vivrà o morirà e restituisce i risultati finali sotto forma di un'immagine 3D. Fondamentalmente, il modello accoppiato può simulare il passare del tempo e quindi mostrare la gravità del danno da radiazioni – e la progressione delle condizioni mediche che può causare – ore, giorni, mesi o addirittura anni dopo il trattamento.
“Ciò che ho trovato molto interessante è che queste simulazioni computazionali hanno effettivamente fornito risultati che corrispondevano a varie osservazioni sperimentali di diversi gruppi, laboratori e ospedali. Quindi il nostro approccio computazionale potrebbe in linea di principio essere utilizzato in un contesto clinico”, afferma Bauer, portavoce internazionale Collaborazione BioDynaMo, che mira a introdurre nuovi metodi computazionali nel settore sanitario tramite la suite software utilizzata per costruire questo modello.
Bauer ha iniziato a lavorare su modelli computazionali del cancro dopo che un suo caro amico è morto a causa della malattia all’età di soli 34 anni. “Ogni cancro è diverso e ogni persona è diversa, con organi di forma diversa, predisposizioni genetiche e stili di vita”, spiega. La sua speranza è che le informazioni provenienti da scansioni, biopsie e altri test possano essere inserite nel nuovo modello per fornire un quadro di ciascun individuo. Potrebbe quindi essere creato un protocollo terapeutico assistito dall’intelligenza artificiale che produrrebbe un piano di trattamento su misura in grado di migliorare le possibilità di sopravvivenza del paziente.
La pianificazione specifica per il paziente potrebbe migliorare i risultati della radioterapia
Bauer sta attualmente cercando collaboratori di altre discipline, inclusa la fisica, per aiutare a procedere verso una sperimentazione clinica su pazienti affetti da cancro ai polmoni per diversi anni. Nel frattempo, il team intende espandere l’uso del modello in altri settori della medicina.
Durante, ad esempio, spera di studiare l’infezione virale con questo modello polmonare poiché “potrebbe prevedere la polmonite indotta dall’infezione da COVID-19”. Intanto Bauer ha iniziato a simulare lo sviluppo di circuiti nel cervello dei bambini prematuri, con l'obiettivo di capire meglio “a che ora intervenire e come”.
- Distribuzione di contenuti basati su SEO e PR. Ricevi amplificazione oggi.
- PlatoData.Network Generativo verticale Ai. Potenzia te stesso. Accedi qui.
- PlatoAiStream. Intelligenza Web3. Conoscenza amplificata. Accedi qui.
- PlatoneESG. Carbonio, Tecnologia pulita, Energia, Ambiente, Solare, Gestione dei rifiuti. Accedi qui.
- Platone Salute. Intelligence sulle biotecnologie e sulle sperimentazioni cliniche. Accedi qui.
- Fonte: https://physicsworld.com/a/modelling-lung-cells-could-help-personalize-radiotherapy/
- :ha
- :È
- :non
- $ SU
- 135
- 3d
- a
- capace
- WRI
- AC
- raggiunto
- effettivamente
- amministrato
- influenzare
- Dopo shavasana, sedersi in silenzio; saluti;
- anni
- agenti
- mira
- ARIA
- Tutti
- consente
- Sebbene il
- an
- ed
- in qualsiasi
- approccio
- SONO
- aree
- AS
- At
- precedente
- basato
- basic
- base
- BE
- perché
- diventare
- ha iniziato
- iniziato
- Meglio
- fra
- respirazione
- portare
- costruire
- costruisce
- by
- Materiale
- Cancro
- Cellule cancerogene
- svolta
- Custodie
- Causare
- cella
- Celle
- probabilità
- scelto
- Info su
- Chiudi
- strettamente
- collaborazione
- collaboratori
- computazionale
- computer
- condizioni
- Consistente
- contrasto
- potuto
- accoppiato
- COVID-19
- creato
- in modo cruciale
- Attualmente
- danno
- Giorni
- consegnato
- Shirts Department
- descritta
- sviluppato
- Mercato
- *
- morto
- diverso
- Direttore
- discipline
- Malattia
- distribuzione
- dose
- ogni
- Efficace
- Anche
- Ogni
- coinvolgenti
- Espandere
- esperienza
- sperimentale
- Spiega
- Federale
- finale
- i seguenti
- Nel
- modulo
- essere trovato
- frazione
- Amico
- da
- generalizzata
- genetico
- Germania
- scopo
- Gruppo
- Metà
- accade
- he
- assistenza sanitaria
- sano
- Aiuto
- superiore
- il suo
- speranza
- sperando
- ospedali
- ORE
- Come
- HTTPS
- i
- competenze
- migliora
- in
- Compreso
- individuale
- informazioni
- lesioni
- esempio
- intende
- si interagisce
- interagisce
- Internazionale
- intervenire
- ai miglioramenti
- problema
- IT
- SUO
- jpg
- ad appena
- uccisione
- Labs
- Livello
- stili di vita
- LIMITE
- fodera
- vivere
- SEMBRA
- abbinato
- max-width
- Maggio..
- Nel frattempo
- medicale
- medicina
- metodi
- microscopico
- modello
- modellismo
- modelli
- mese
- Scopri di più
- cambiano
- Natura
- New
- GENERAZIONE
- of
- on
- ottimizzati
- or
- minimo
- Altro
- nostro
- su
- risultati
- produzione
- uscite
- ancora
- complessivo
- passaggio
- passato
- paziente
- pazienti
- persona
- personalizzare
- Personalizzata
- Fisica
- Mondo della fisica
- immagine
- piano
- pianificazione
- Platone
- Platone Data Intelligence
- PlatoneDati
- punto
- predire
- Precoce
- principio
- progressione
- protocollo
- fornire
- Radioterapia
- reazioni
- destinatari
- riparazione
- rappresentazione
- Risultati
- rivelare
- dice
- Scala
- scansioni
- schemi
- cerca
- segmento
- separato
- grave
- regolazione
- alcuni
- a forma di
- mostrare attraverso le sue creazioni
- simulare
- simulazioni
- simulatore
- So
- Software
- alcuni
- portavoce
- Di partenza
- statistiche
- Ancora
- Studio
- tale
- suite
- Surrey
- sopravvivenza
- su misura
- team
- test
- Grazie
- che
- Il
- Regno Unito
- si
- poi
- terapia
- perciò
- Strumenti Bowman per analizzare le seguenti finiture:
- questo
- miniature
- così
- tempo
- a
- verso
- trattati
- trattamento
- prova
- innescare
- vero
- Digitare
- Uk
- e una comprensione reciproca
- unità
- uso
- utilizzato
- usa
- utilizzando
- vario
- molto
- via
- virale
- Che
- quando
- se
- quale
- while
- con
- entro
- Lavora
- allenarsi
- lavoro
- mondo
- sarebbe
- anni
- zefiro