Il carcinoma mammario triplo negativo (TNBC) è un sottotipo aggressivo associato a recidiva metastatica precoce e peggiori esiti dei pazienti. Il tumore esprime marcatori molecolari della transizione epiteliale-mesenchimale, ma il suo requisito durante la metastasi spontanea del TNBC in vivo rimane incompleto.
Gli scienziati di Johns Hopkins Medicine hanno identificato variazioni molecolari significative tra le cellule tumorali che si aggrappano a un tumore iniziale e quelle che si diffondono per formare tumori distanti.
Andrew Ewald, Ph.D., Virginia DeAcetis Professor in Basic Science Research e Direttore, Dipartimento di Biologia Cellulare presso la Johns Hopkins University School of Medicine, ha dichiarato: “Abbiamo da tempo bisogno di nuovi obiettivi di trattamento e opzioni per il seno triplo negativo tumori. Questi tumori spesso si ripresentano entro tre anni dalla diagnosi e i trattamenti utilizzati per altri tumori al seno in genere non funzionano per il triplo negativo”.
Gli scienziati hanno condotto lo studio su modelli murini e tessuti umani. Questa forma di cancro è particolarmente letale perché manca di segnali molecolari sulla sua superficie che si legano con gli ormoni progesterone e estrogeni, così come la proteina che promuove il cancro Her2-neu. Più cancro al seno i trattamenti odierni prendono di mira quei marcatori, rendendoli inefficaci per quelli con tumori triplo-negativi.
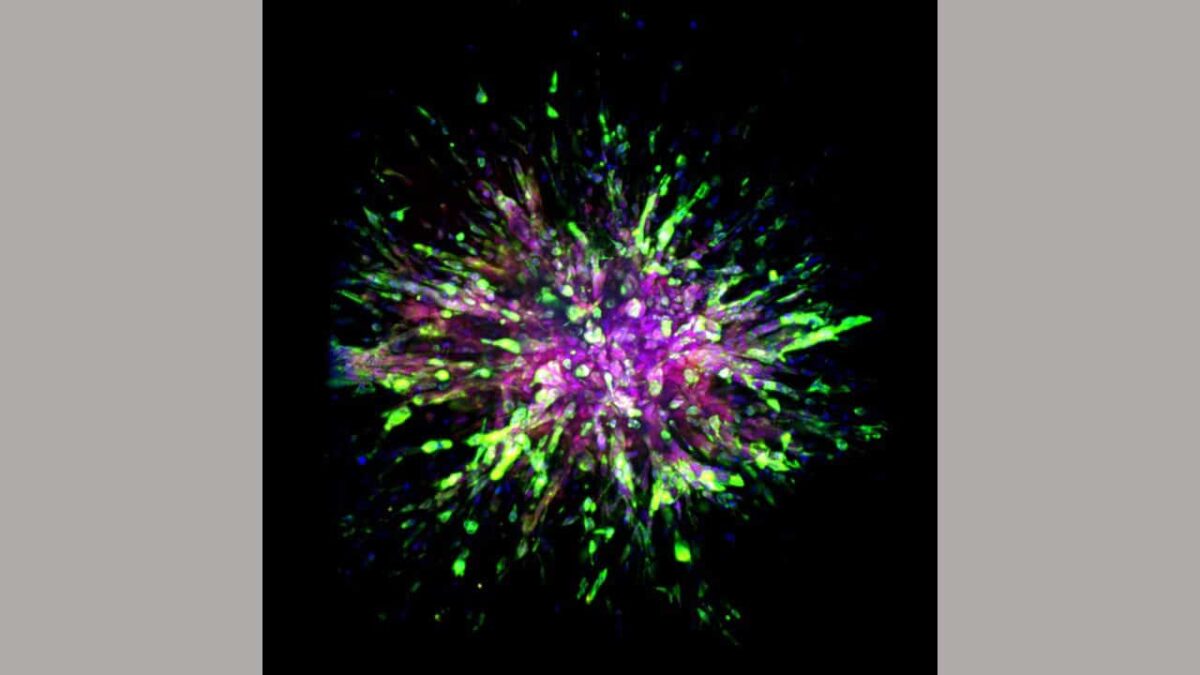
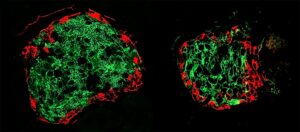
Gli scienziati, in questo studio, hanno osservato attentamente le differenze molecolari tra i siti di carcinoma mammario triplo negativo iniziale o primario e le aree in cui si è diffuso, o siti metastatici, tra tre diversi tipi di cellule: modelli murini, tumori umani impiantati nei topi e campioni di tessuti primari e metastatici prelevati da otto pazienti.
Utilizzando tecniche come machine learning, imaging cellulare e analisi biochimica, gli scienziati hanno identificato le differenze tra i modelli di espressione genomica dei tumori primari e metastatici.
Ewald ha detto, “La cattiva notizia del nostro studio è che le cellule dei siti metastatici sono super ottimizzate per la migrazione e per resistere al trattamento. La buona notizia è che abbiamo identificato diverse proteine chiamate fattori di trascrizione che queste cellule richiedono per gestire le sfide della migrazione e della crescita nei siti metastatici. Potremmo essere in grado di progettare nuove terapie che prendono di mira questi fattori di trascrizione”.
Gli scienziati hanno notato diverse caratteristiche distintive nelle cellule dei topi a cui sono stati impiantati tumori al seno triplo-negativi umani o nei topi modificati per avere la versione murina della malattia. Ancora più importante, hanno scoperto che l'invasione di cellule di cancro al seno triplo negativo ad altri tessuti in un'altra parte del corpo, le cellule ottengono due proprietà cellulari: migliore movimento e sopravvivenza.
Per raggiungere questo obiettivo, le cellule del cancro al seno acquisiscono la proteina dello scheletro cellulare della vimentina, che migliora la capacità delle cosiddette cellule mesenchimali di migrare e generare nuove cellule. Le cellule mesenchimali sono un tipo di cellula che si trova generalmente nelle ossa e midollo osseo.
La produzione di una proteina chiamata caderina offre vantaggi in termini di sopravvivenza alle cellule di cancro al seno triplo negativo. La proteina si trova tipicamente nelle cellule epiteliali che rivestono i dotti e le coperture degli organi e si rinnovano frequentemente.
Gli scienziati classificano il loro stato cellulare come le cosiddette cellule ibride epiteliali-mesenchimali (EMT) quando le cellule di cancro al seno triplo negativo ottengono tali qualità di sopravvivenza e migratorie.
Con l'aiuto di Elana Fertig, Ph.D., direttrice di divisione e direttrice associata di scienze quantitative e co-direttore del Convergence Institute presso il Johns Hopkins Kimmel Cancer Center, gli scienziati hanno osservato attentamente le molecole coinvolte negli stati EMT ibridi. Hanno anche monitorato i modelli molecolari delle singole cellule in saggi cellulari che modellano l'invasione dal tumore primario e la formazione di una colonia in un sito metastatico.
I ricercatori hanno utilizzato tecniche di apprendimento automatico per identificare i modelli nell'espressione di ciascuna cellula RNA, un parente del DNA coinvolto nella sintesi proteica. La maggior parte delle cellule metastatiche, hanno scoperto i ricercatori, si trasforma nello stato ibrido EMT, che è più migratorio e più resiliente. Quindi, gli scienziati hanno esaminato i tumori primari e i tessuti dei siti metastatici degli stessi pazienti per convalidare stati simili in campioni di otto pazienti con neoplasie triple negative.
A livello molecolare, la maggior parte delle cellule metastatiche produce cinque proteine chiamate fattori di trascrizione (Grhl2, Foxc2, Zeb1, Zeb2 e Ovol1) che favoriscono la produzione di proteine coinvolte nell'invasione delle cellule tumorali o nella formazione di colonie.
Ewald disse, "Le differenze molecolari tra tumori metastatici e primari sono probabilmente il motivo per cui le cellule tumorali metastatiche sono così resistenti ai trattamenti attuali".
Gli scienziati stanno ora studiando modi per bloccare i geni dei fattori di trascrizione o le loro proteine risultanti per fermare la crescita del cancro metastatico e se gli stessi cambiamenti molecolari e cellulari si verificano in altri tumori, come quelli del colon, delle ghiandole surrenali, dello stomaco e dell'intestino tenue.
Riferimento della Gazzetta:
- Eloise M. Grasset, Matthew Dunworth, et al. La metastasi del carcinoma mammario triplo negativo coinvolge complesse dinamiche di transizione epiteliale-mesenchimale e richiede vimentina. Science Translational Medicine. DOI: 10.1126/scitranslmed.abn7571