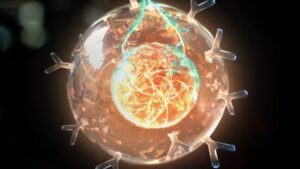
מזרק מולקולרי זעיר עם מקורות מוזרים יכול לשנות את אחת הבעיות הקשות ביותר ברפואה: להביא תרופות ליעדי היעד שלהן בתוך הגוף. המקור? חיידקים החיים במעיים של חרקים.
ילד המוח של ד"ר פנג ג'אנג במכון הרפואי הווארד יוז וברוד מכון, הננו-מכונה הקפיצית נראית קצת כמו ספינת רקטות. לאחר עגינה, מזרק יורה למטה כדי לחדור לתאים ולספק מטענים יקרים.
כאשר פיתחו עוד יותר, המזרקים המולקולריים יכלו להעביר אימונותרפיות סרטן רק לתאי הגידול, לחסוך על בריאים ולהגביל תופעות לוואי. המערכת יכולה גם לעבור בבטחה לתוך המוח - איבר ידוע לשמצה שקשה לגשת אליו לתרופות - שעלול להוביל חלבונים שיכולים לסייע באבחון שבץ מוחי, אלצהיימר והפרעות נוירולוגיות אחרות.
פורסם ב טבע, המזרק נוצר בהשראת ממלכת החיידקים. ג'אנג אינו זר לחקר החומר האפל של הביוורס. הידוע בעיקר בזכות עבודתו המכוננת על עריכת גנים CRISPR-Cas9, שמקורה כמערכת הגנה חיידקית מפני וירוסים, ז'אנג לקח זמן רב רמזים מהאבולוציה כדי ליצור פלאים ביוטכנולוגיים של הדור הבא.
עם זאת, הפעם הצוות שלו הביא עוד משתף פעולה לתמהיל: AlphaFold.
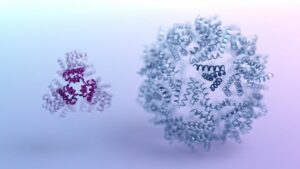
ה-AI שפותח על ידי DeepMind, עלה לכותרות בגלל יכולתו המופלאה לעשות זאת לחזות מבני חלבון. תוך שימוש בכלי, הצוות עשה אופטימיזציה של חלק הליבה של מזרק החיידקים, וגרם לו לעבור מהמטרה המועדפת עליהם - תאי חרקים - למגוון עכברים ובני אדם.
מספר מחקרים הוכחה לקונספט הן בתאים מתורבתים והן בעכברים הציגו את יכולתו של המזרק החדש. ניסוי אחד העביר רעלן לתאים סרטניים מבלי לפגוע באחרים. אחר הזריק את Cas9 - ה"מספריים" החלבון בכלי לעריכת הגנים CRISPR - לתאים אנושיים מתורבתים וערך את גני המטרה ביעילות גבוהה.
היכולת הזו לחבר ולשחק הופכת את המערכת למעצמת אספקה. "אנחנו מראים שרק על ידי הנחת תג על החלבון, אנחנו יכולים להעמיס סוגים שונים של חלבונים לתוך המחטים האלה," אמר ג'אנג.
"היכולת לספק חלבונים מסוימים לסוגי תאים ספציפיים תציע פוטנציאל אדיר למחקר במדעי החיים, כמו גם לטיפול במחלות." אמר צ'ארלס אריקסון וד"ר מרטין פילהופר ב-ETH ציריך, שלא היו מעורבים בעבודה.
המערכת, בשילוב עם אחרים, מציבה את הבסיס לארגז כלים רב עוצמה עבור שילוב והתאמה הן למחקר והן לרפואה. למרות שכרגע הוא מסוגל להעביר חלבונים בלבד, שיתוף פעולה עם מזרקים מולקולריים טבעיים אחרים יכולה להרחיב את המערכת ל-DNA ולביומולקולות אחרות.
"זה עדיין הימים הראשונים של זה כטכנולוגיה," אמר ג'אנג.
סיוטי מסירה
תארו לעצמכם את משלוח התרופה בתור DoorDash. אתה רוצה שההזמנה שלך תגיע רק אליך, לא לשכנים שלך, ועם האוכל שלם.
זה נשמע טריוויאלי, אבל זו משימה שקשה להשיג עם תרופות וריפוי גנטי. תרופות בצורת כדורים, מדבקות או מחטים לווריד - חשבו על שקיות מי מלח או כימותרפיות - נכנסות למחזור הדם. התוצאה היא שהם מציפים איברים ורקמות שונים ולעיתים גורמים לתופעות לוואי.
בניגוד גמור, בעיה נוספת היא שתרופות מסוימות לא יכולות לחפור במטרות שלהן. תאים הם מבצרים המוקפים בקרום שומני דו-שכבתי, עם מנגנונים שלעיתים יורקים פולשים לא רצויים באופן אקטיבי. כאשר אותם פולשים הם אלמנטים של ריפוי גנטי או חלבונים טיפוליים, מערכת ההגנה של התאים הופכת לכאב ראש עצום.
מדענים המציאו דרכים לעקוף את ההגנות הללו. האחת היא שימוש בנגיפים לא מזיקים כדי להבריח חומרי חיסון. אחר הוא ננוספרות שומניות, העשויות מבועות שומניות קטנות. לאחר התמזגות עם התא, הבועות "מתפוצצות" ומשחררות את המטען. למרות הבסיס להנדסה גנטית, מערכות אלו אינן מדויקות כפי שהיינו רוצים. אם נחזור לאנלוגיה של DoorDash, ה-dasher ייתן לך חלק מההזמנה שלך - תוך שהוא מביא את השאר לשכניך התמימים והלא רוצים.
השראה חיידקית
במחקר החדש, ז'אנג זרק את ספר המשחק ויצא לגמרי מחוץ לקופסה. הוא ועמיתו ג'וזף קרייץ הקישו על מזרק מולקולרי שנוצר על ידי האבולוציה.
המשאב הבלתי צפוי הוא חיידק ביולוגי הנקרא Photorhabdus asymbiotica, שחי במעיים של חרקים. הם מגיעים חמושים בכבדות: כל אחד מהם מצויד במזרקים מולקולריים זעירים - באורך של כ-100 ננומטר - עם "רגליים" שאוחזות בתאי מארח. לאחר עגינה, בוכנה נוסעת דרך הממברנה של התא, ויורה פנימה רעלן שהורג את המארח - ובתמורה מאפשרת לחיידקים לברוח ולהתנחל בתאים אחרים.
המנגנון שנשמע מסוכן - המכונה מערכת הזרקה מתכווצת, או CIS - בקושי נראה מתאים למערכת אספקה בטוחה. אבל מוזרות אחת תפסה את עיני הצוות: מזרקי חיידקים עובדים בדרך כלל רק עם חיידקים אחרים, לא תאים של בעלי חיים. אז למה לא לשחזר את photorhabdus מזרק להזריק גם תאים אנושיים?
הצוות התחדד לראשונה בחלק מהמזרק שנקרא סיבי זנב. "הדברים דמויי המחושים" האלה עוזרים לננו-מכונה להיצמד לתאים, הסביר ג'אנג. המפתח הוא התאמת הקולטנים, או תחנות העגינה, על פני התאים. לכל סוג תא יש מספר עצום של רציפים ייחודיים לאופי הביולוגי שלהם - לנוירון, למשל, יש כמה שונים באופן מסיבי מאלה של תאי הלב. אלה מיצורים חיים שונים שונים אפילו יותר.
לכן אין זה מפתיע שהמזרקים, שנועדו לעבוד בתאי חרקים, נכשלו בתאי אדם. בידיעה שסיבי הזנב הם העיקר, הצוות הביא משתף פעולה חדש: AlphaFold. באמצעות ה-AI, הצוות יצר מודל תלת-ממדי של החלבון המסובך שנמצא באזור שמנחה את המזרק לעבר תאי חרקים.
לאחר מכן הם שינו גנטית את האזור הזה, קיצצו את קצה סיבי הזנב והוסיפו נתחי חלבון שונים כדי להנחות את המזרק לעבר תאים ספציפיים של עכבר ותאים אנושיים.
"[AlphaFold] נתן לנו את המידע שהיינו צריכים כדי ליצור אסטרטגיית מסירה חדשה שניתן לשנות כדי למקד לתאים שונים," אמר קרייץ.
לערבב ולהתאים
הצוות בדק את המזרקים הניתנים לתכנות שלהם בכמה ניסויים.
באחד, הם העמיסו על המזרק חלבון שברגע שהוזרק, גרם לתאים אנושיים בתרבית להאיר בירוק תוסס בחושך. מזרק דומה עובד מחדש כדי לאתר תאים סרטניים המנוקדים בקולטן לגורם גדילה אפידרמיס (EGFR) על פני השטח שלו. עמוס ברעלים, הטיפול הרג כמעט את כל התאים עם הקולטן אך חסך על אחרים. באופן דומה, הצוות העביר בקלות את Cas9 למגוון תאים אנושיים, שכאשר סופק להם RNA מנחה ערכו את הגנום בנקודות חזויות.
לבסוף, במבחן האולטימטיבי, הצוות הזריק את המערכת להיפוקמפוס של עכברים. כשהם חדורים בחלבון ניאון, התאים זוהרו בירוק עז. חשוב לציין, למרות שנגזרו מחיידקים, המזרקים לא הפעילו תגובה חיסונית.
המערכת לא מושלמת. למרות שהוא יעיל ברקמות שנבדקו, הצוות מקווה להרחיב את המגוון שלו לסוגים שונים של רקמות ומודלים של מחלות. מטרה נוספת היא לחפש אחר מזרקים טבעיים אחרים ואפשר לגדל אותם למשפחה שלמה של כלי משלוח - ברוח הדומה לצמיחה של CRISPR. לעת עתה, המערכת נושאת רק חלבונים. אבל הנדסה נוספת יכולה לאפשר מסירה ספציפית של DNA, RNA וביומולקולות אחרות, ואולי אפילו לשלוט במינון שלהן.
"זה עדיין מוקדם לגישה הזו, אבל אני חושב שזה באמת חשוב לחקור את [יכולת המערכת] להיות מסוגל לטפל בסוגים רבים ושונים של מחלות המשפיעות על בריאות האדם", אמר ג'אנג.
קרדיט תמונה: Joseph Kreitz, Broad Institute of MIT והרווארד, McGovern Institute for Brain Research ב-MIT
- הפצת תוכן ויחסי ציבור מופעל על ידי SEO. קבל הגברה היום.
- Platoblockchain. Web3 Metaverse Intelligence. ידע מוגבר. גישה כאן.
- מקור: https://singularityhub.com/2023/04/04/this-amazing-molecular-syringe-could-smuggle-drugs-and-gene-therapies-into-human-cells/
- :הוא
- 100
- 3d
- a
- יכולת
- יכול
- להשיג
- באופן פעיל
- להשפיע על
- נגד
- AI
- תעשיות
- מאפשר
- למרות
- אלצהיימר
- מדהים
- ו
- בעלי חיים
- אחר
- גישה
- ARE
- חמוש
- AS
- At
- בחזרה
- בַּקטֶרִיָה
- שקיות
- BE
- הופך להיות
- הטוב ביותר
- קצת
- גוּף
- אריזה מקורית
- מוֹחַ
- בָּהִיר
- מביאים
- רחב
- מובא
- by
- נקרא
- CAN
- מחלת הסרטן
- תאים סרטניים
- מסוגל
- נתפס
- לגרום
- גרם
- תאים
- צ'ארלס
- ילד
- קיצוץ
- עמית
- משולב
- איך
- לחלוטין
- לעומת זאת
- לִשְׁלוֹט
- ליבה
- יכול
- לעצב
- אשראי
- תַרְבּוּת
- כיום
- כהה
- חומר אפל
- ימים
- Deepmind
- גופי בטחון
- למסור
- נתן
- מסירה
- נגזר
- מעוצב
- יעדים
- מפותח
- אחר
- קשה
- מַחֲלָה
- מחלות
- הפרעות
- ה-DNA
- מטה
- תרופה
- סמים
- כל אחד
- מוקדם
- בקלות
- תופעות
- יְעִילוּת
- יעיל
- אלמנטים
- הנדסה
- מְצוּיָד
- ETH
- אֲפִילוּ
- אבולוציה
- דוגמה
- לְהַרְחִיב
- לְנַסוֹת
- מוסבר
- לחקור
- היכרות
- עין
- נכשל
- משפחה
- סיבים
- ראשון
- מתאים
- מבול
- מזון
- בעד
- טופס
- מצא
- קרן
- החל מ-
- נוסף
- עריכת גנים
- נוצר
- הנדסה גנטית
- מקבל
- לתת
- מטרה
- הולך
- לתפוס
- ירוק
- לגדול
- צמיחה
- מדריך
- מדריך
- קשה
- פוגע
- הרווארד
- יש
- כותרות
- בְּרִיאוּת
- בריא
- לֵב
- לעזור
- גָבוֹהַ
- רמזים
- מקווה
- המארח
- אולם
- HTTPS
- בן אנוש
- i
- חשוב
- in
- מידע
- השראה
- מכון
- מעורב
- IT
- שֶׁלָה
- jpg
- מפתח
- מלכות
- יודע
- ידוע
- החיים
- מדעי חיים
- כמו
- קְצָת
- חי
- חי
- לִטעוֹן
- ארוך
- נראה
- עשוי
- לעשות
- עושה
- עשייה
- רב
- סנונית
- מסיבי
- באופן מאסיבי
- תואם
- חומרים
- דבר
- רפואי
- רפואה
- MIT
- מודל
- מודלים
- שונים
- מולקולרי
- יותר
- טבעי
- טבע
- כמעט
- השכנים
- חדש
- הדור הבא
- of
- הַצָעָה
- on
- ONE
- אופטימיזציה
- להזמין
- מקורו
- אחר
- אחרים
- בחוץ
- לְשַׁפֵּץ
- חלק
- מסוים
- טלאים
- אוּלַי
- אפלטון
- מודיעין אפלטון
- אפלטון נתונים
- לְשַׂחֵק
- תקע
- Plug and Play
- נקודות
- פוטנציאל
- פוטנציאל
- חזק
- יָקָר
- צורך
- חזה
- מועדף
- בעיה
- בעיות
- חֶלְבּוֹן
- חלבונים
- תְעוּזָה
- מכניס
- רכס
- באזור
- לשחרר
- מחקר
- משאב
- תגובה
- REST
- תוצאה
- רנ"א
- רקטה
- בטוח
- בבטחה
- אמר
- מדעים
- נראה
- סטים
- כמה
- ספינה
- יְרִי
- לְהַצִיג
- צד
- דומה
- באופן דומה
- So
- כמה
- מָקוֹר
- ספציפי
- מוּחלָט
- תחנות
- עוד
- זר
- אִסטרָטֶגִיָה
- מחקרים
- לימוד
- שסופק
- משטח
- הפתעה
- מוּקָף
- מתג
- מערכת
- מערכות
- תָג
- טפח
- יעד
- מטרות
- המשימות
- נבחרת
- טכנולוגיה
- מבחן
- זֶה
- השמיים
- המידע
- המקור
- שֶׁלָהֶם
- אותם
- אלה
- דרך
- זמן
- ל
- כלי
- ארגז כלים
- לקראת
- לעקוב
- טיפול
- טיפול
- עָצוּם
- להפעיל
- תור
- סוגים
- האולטימטיבי
- לא צפוי
- ייחודי
- לא רצוי
- us
- להשתמש
- בְּדֶרֶך כְּלַל
- תרכיב
- מגוון
- מלא חיים
- וירוסים
- דרכים
- טוֹב
- אשר
- בזמן
- מי
- כל
- יצטרך
- עם
- לְלֹא
- תיק עבודות
- היה
- אתה
- זפירנט