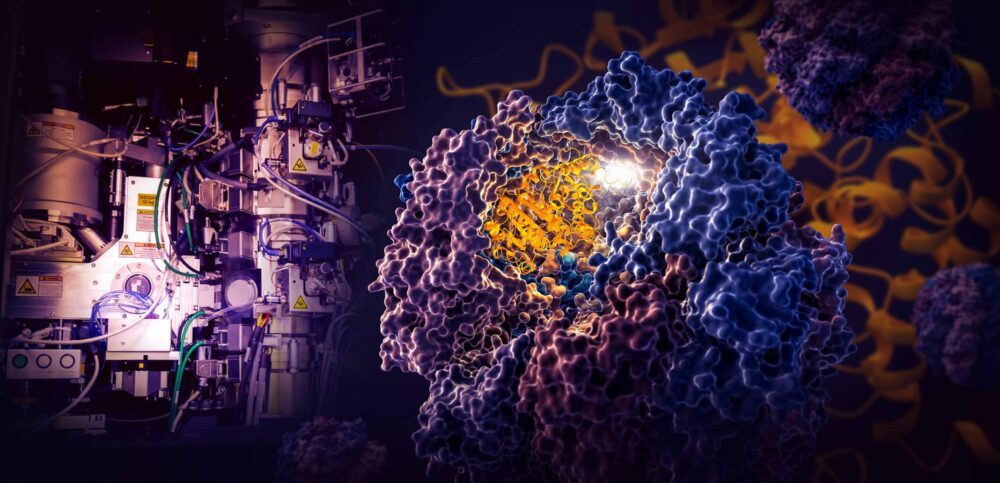
מחקר ציון דרך שנערך על ידי חוקרים במעבדת המאיץ הלאומית של מחלקת האנרגיה SLAC ואוניברסיטת סטנפורד חושף כיצד מכונה סלולרית זעירה בשם TRiC מכוונת את הקיפול של טובולין, חלבון אנושי המהווה את אבן הבניין של המיקרוטובולים המשמשים כפיגום והתחבורה של התא. .
עד כה, מדענים חשבו שמכונות TRiC ומכונות דומות, הידועות כצ'פרונינים, מספקות באופן פסיבי סביבה מתאימה לקיפול, אך אינן משתתפות בה ישירות.
עד 10% מהחלבונים בתאים שלנו, כמו גם אלה בצמחים ובעלי חיים, מקבלים עזרה מעשית מהחדרים הקטנים האלה בקיפול לצורות הסופיות והפעילות שלהם, העריכו החוקרים.
רבים מהחלבונים שמתקפלים בעזרת TRiC קשורים קשר הדוק למחלות אנושיות, כולל סוגי סרטן מסוימים והפרעות ניווניות כמו פרקינסון, הנטינגטון ואלצהיימר, אמרה פרופסור בסטנפורד ג'ודית פרידמן, אחת המחברים הראשיים של המחקר.
למעשה, היא אמרה, הרבה תרופות נוגדות סרטן נועדו לשבש את טובולין ואת המיקרוטובוליות שהוא יוצר, שחשובות באמת לחלוקת התאים. אז מיקוד לתהליך קיפול טובולין בסיוע TRiC יכול לספק אסטרטגיה אטרקטיבית נגד סרטן.
הצוות דיווח על תוצאות המחקר בן העשור שלהם במאמר שפורסם ב תא היום.
"זהו מבנה החלבון המרגש ביותר שעבדתי עליו במהלך 40 שנות הקריירה שלי", אמר פרופסור SLAC/סטנפורד וואה צ'יו, חלוץ בפיתוח ושימוש במיקרוסקופ אלקטרוני קריוגני (cryo-EM) ומנהל חטיבת ה-cryo-EM והביו-הדמיה של SLAC.
"כשפגשתי את יהודית לפני 20 שנה", הוא אמר, "דיברנו אם אנחנו יכולים לראות חלבונים מתקפלים. זה משהו שאנשים ניסו לעשות במשך שנים, ועכשיו עשינו את זה".
החוקרים תפסו ארבעה שלבים ברורים בתהליך הקיפול המכוון TRiC ברזולוציה קרובה לאטומית עם cryo-EM, ואישרו את מה שהם ראו בניתוחים ביוכימיים וביופיזיים.
ברמה הבסיסית ביותר, אמר פרידמן, מחקר זה פותר את החידה ארוכת השנים מדוע טובולין אינו יכול להתקפל ללא הסיוע של TRiC: "זה באמת משנה משחק בכך שהוא סוף סוף מביא דרך חדשה להבין איך חלבונים מתקפלים בתא האנושי."
קיפול ספגטי לפרחים
חלבונים ממלאים תפקידים חיוניים כמעט בכל דבר שתא עושה, ולגלות כיצד הם מתקפלים למצבי התלת-ממד הסופי שלהם הוא אחד המשימות החשובות ביותר בכימיה ביולוגיה.
כדברי צ'יו, "חלבון מתחיל בתור מחרוזת חומצות אמינו שנראית כמו ספגטי, אבל היא לא יכולה לתפקד עד שהיא מתקפלת לפרח בדיוק בצורה הנכונה."
מאז אמצע שנות ה-1950, התמונה שלנו על אופן קיפול החלבונים עוצבה על ידי ניסויים שנעשו באמצעות חלבונים קטנים על ידי חוקר המכון הלאומי לבריאות כריסטיאן אנפינסן. הוא גילה שאם יפרש חלבון קטן, הוא יחזור באופן ספונטני לאותה צורה, והגיע למסקנה שהכיוונים לעשות זאת מקודדים ברצף חומצות האמינו של החלבון. אנפינסן חלק את פרס נובל לשנת 1972 ב כימיה על הגילוי הזה.
30 שנה מאוחר יותר, חוקרים גילו שמכונות סלולריות מיוחדות עוזרות לקפל חלבונים. אבל הדעה הרווחת הייתה שתפקידם מוגבל לעזרה לחלבונים לבצע את הקיפול הספונטני שלהם על ידי הגנה עליהם מלהילכוד או להדליק יחד.
סוג אחד של מכונה עוזרת, הנקראת צ'פרונין, מכילה תא דמוי חבית שמחזיק חלבונים בפנים בזמן שהם מתקפלים. TRiC מתאים לקטגוריה זו.
תא ה-TRiC ייחודי בכך שהוא מורכב משמונה יחידות משנה שונות היוצרות שתי טבעות מוערמות. גדיל ארוך ורזה של חלבון טובולין מועבר לפתח החדר על ידי מולקולת עוזרת בצורת מדוזה. ואז מכסה החדר נסגר ומתחיל הקיפול. בסיום, המכסה נפתח ועלי הטובולין המוגמרים והמקופלים.
מכיוון שטובולין לא יכול להתקפל ללא TRiC, נראה היה ש-TRiC עשוי לעשות יותר מאשר לעזור לטובולין באופן פסיבי להתקפל באופן ספונטני. אבל איך זה בדיוק עובד? מחקר חדש זה עונה על השאלה הזו ומוכיח שלפחות עבור חלבונים כמו טובולין, המושג "קיפול ספונטני" אינו חל. במקום זאת, TriC מתזמר ישירות את מסלול הקיפול המוביל לחלבון המעוצב בצורה נכונה.
למרות שההתקדמות האחרונה בתחום הבינה המלאכותית, או AI, יכולה לחזות את המבנה המוגמר והמקופל של רוב החלבונים, אמר פרידמן, AI לא מראה כיצד חלבון משיג את צורתו הנכונה. ידע זה הוא בסיסי לשליטה בקיפול בתא ולפיתוח טיפולים למחלות קיפול. כדי להשיג מטרה זו, החוקרים צריכים להבין את השלבים המפורטים של תהליך הקיפול כפי שהוא מתרחש בתא.
תא סלולרי לוקח אחריות
לפני עשר שנים, פרידמן, צ'יו וצוותי המחקר שלהם החליטו להעמיק במה שקורה בתא ה-TRIC.
"בהשוואה לחדרי הקיפול הפשוטים יותר של צ'פרונינים בחיידקים, ה-TRiC בתאים אנושיים הוא מכונה מאוד מעניינת ומסובכת." אמר פרידמן. "לכל אחת משמונה יחידות המשנה שלה יש תכונות שונות והיא מציגה משטח נבדל בתוך החדר, וזה מתברר כחשוב מאוד."
המדענים גילו שהחלק הפנימי של החדר הייחודי הזה מכוון את תהליך הקיפול בשתי דרכים.

(Yanyan Zhao/אוניברסיטת סטנפורד)
כאשר מכסה החדר נסגר מעל חלבון, אזורים של מטען אלקטרוסטטי מופיעים על הדפנות הפנימיות שלו. הם מושכים חלקים טעונים הפוך של גדיל חלבון הטובולין ובעצם מצמידים אותם לקיר כדי ליצור את הצורה והתצורה הנכונות לשלב הבא בקיפול. בינתיים, "זנבות" של תת-יחידת TRiC המשתלשלים מדופן החדר תופסים את חלבון הטובולין בזמנים ובמקומות ספציפיים כדי לעגן ולייצב אותו.
כדי להתחיל, קצה אחד של גדיל טובולין מתחבר לכיס קטן בקיר ומתקפל. ואז הקצה השני מתחבר במקום אחר, ויוצר לולאה גדולה. הלולאה מתקפלת באופן שמביא אותה ממש ליד האזור המקופל הראשון.
בשלב השלישי, חלק מהחלק האמצעי מתקפל ליצירת הליבה של החלבון, יחד עם כיסים שבהם GTP, מולקולה האוגרת ומשחררת אנרגיה כדי להפעיל את עבודת התא, יכולה להתחבר.
לבסוף, קטע החלבון הנותר מתקפל. מולקולת הטובולין מוכנה כעת לפעולה.
"תצלומי מצב מבניים אלה של שלבי ביניים ברצף הקיפול מעולם לא נראו בעבר במיקרוסקופ קריו-אלקטרון." אמר פרידמן.
שילוב עוצמתי של טכניקות
הצוות שלה אישר את רצף הקיפול עם סדרה מאתגרת של בדיקות ביוכימיות וביופיזיות שדרשו שנים של עבודה.
פירוש תוצאות אלו אפשר לחוקרים לבנות תמונה של צורתו המשתנה של הטובולין כשהיא מתקפלת בתוך תא ה-TRiC, שהתאימה לתמונות שנוצרו על ידי cryo-EM.
"זה מאוד חזק להיות מסוגל לעבור הלוך ושוב בין הטכניקות האלה, כי אז אתה באמת יכול לדעת שמה שאתה רואה משקף את מה שקורה בתא", אמר פרידמן.
"המדע הפתיע אותנו עם פתרון ממש מעניין שלא הייתי חוזה".
המחקר מציע גם רמזים להבנת האופן שבו מערכת הקיפול הזו התפתחה בתאים איקריוטיים, המרכיבים צמחים, בעלי חיים ובני אדם, אך לא בתאים פשוטים יותר כמו אלה של חיידקים וארכיאה. ככל שהחלבונים נעשו מורכבים יותר ויותר כדי לשרת את הצרכים של תאים אוקריוטיים, החוקרים מציעים, בשלב מסוים הם לא יכלו להתקפל לצורות שהם היו צריכים כדי לבצע עבודות מסובכות יותר בלי עזרה קטנה. חלבונים אוקריוטיים ותא הצ'פרונין שלהם התפתחו ככל הנראה יחד, אולי החל מהאב הקדמון המשותף האחרון של כל האורגניזמים האוקריוטיים לפני כ-2.7 מיליארד שנים.
בשל מורכבות הניתוחים וההפסקה של המגיפה, המחקר נמשך כל כך הרבה זמן עד שרבים מהאנשים שעבדו עליו עברו לעבודות אחרות. הם כוללים את החוקרים הפוסט-דוקטורנטים דניאל גסטאוט ומירנדה קולייר מהקבוצה של פרידמן, שביצעו את החלק הביוכימי של הפרויקט ודחפו אותו קדימה, ויאנין ז'או, סונג-הון רו, בוקס מא וגרג פינטילי מהקבוצה של צ'יו, שביצעו את הקריו. -ניתוחי EM. תורמים נוספים כללו את Junsun Park, סטודנט בקבוצתו של Roh, ואלכסנדר לייטנר מ-ETH בציריך, שוויץ.
העבודה נתמכה על ידי מענקים ל-Wah Chiu וג'ודית פרידמן מה-NIH ומענקים ל-Soung-Hun Roh, שכיום הוא עוזר פרופסור באוניברסיטה הלאומית של סיאול, מקרן המחקר הלאומי של קוריאה וקרן Suh Kyungbae (SUHF).
כתב עת
- Daniel Gestaut וחב', הדמיה מבנית של מסלול הקיפול של טובולין המכוון על ידי צ'פרונין אנושי TRiC/CCT. תא, 8 בדצמבר 2022 DOI: 10.1016 / j.cell.2022.11.014