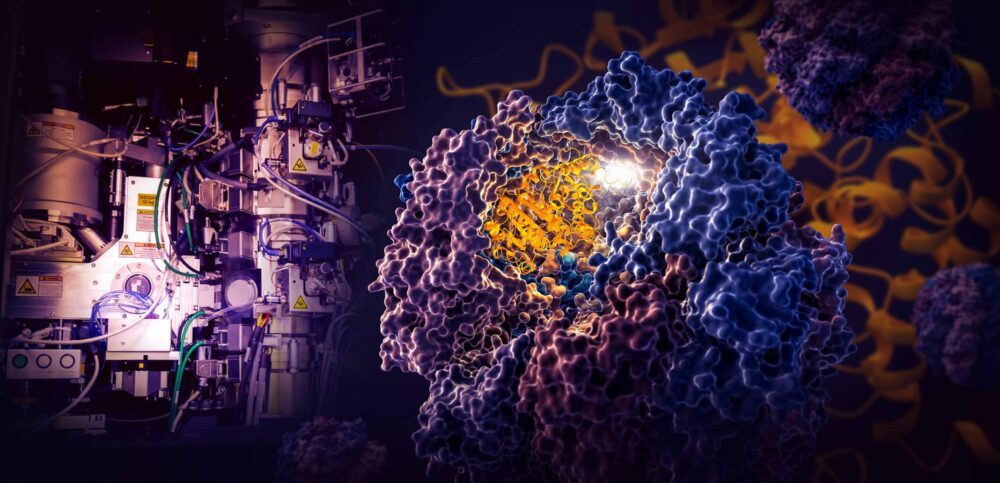
エネルギー省のSLAC国立加速器研究所とスタンフォード大学の研究者らによる画期的な研究は、TRiCと呼ばれる小さな細胞機械が、細胞の足場および輸送システムとして機能する微小管の構成要素であるヒトタンパク質であるチューブリンの折り畳みをどのように指示するかを明らかにした。
これまで科学者らは、TRiC やシャペロニンとして知られる同様の機械が、フォールディングを促進する環境を受動的に提供しているが、フォールディングに直接関与しているわけではないと考えていた。
私たちの細胞だけでなく、植物や動物のタンパク質の最大 10% が、最終的な活性な形状に折りたたまれる際に、これらの小さな部屋から直接的な助けを得ている、と研究者らは推定しています。
研究の筆頭著者の一人であるスタンフォード大学のジュディス・フリードマン教授は、TRiCの助けで折りたたまれるタンパク質の多くは、特定のがんや、パーキンソン病、ハンチントン病、アルツハイマー病などの神経変性疾患を含むヒトの病気と密接に関係していると述べた。
実際、多くの抗がん剤は、細胞分裂に非常に重要なチューブリンとそれが形成する微小管を破壊するように設計されている、と彼女は述べた。したがって、TRiC を利用したチューブリンの折り畳みプロセスを標的とすることは、魅力的な抗がん戦略を提供する可能性があります。
研究チームは、10年にわたる研究の結果を論文で報告し、 セル 。
「これは私が40年のキャリアの中で研究してきた中で最もエキサイティングなタンパク質構造です。」 極低温電子顕微鏡 (cryo-EM) の開発と使用のパイオニアであり、SLAC の極低温 EM およびバイオイメージング部門のディレクターである SLAC/スタンフォード大学の Wah Chiu 教授は次のように述べています。
「20年前にジュディスに会ったとき」 彼は言った、 「私たちはタンパク質が折りたたまれているのが見えるかどうかについて話し合いました。それは人々が何年にもわたってやろうとしてきたことであり、私たちは今それを達成しました。」
研究者らは、TRiC による折り畳みプロセスの 4 つの異なるステップを原子に近い分解能でクライオ EM で捕捉し、生化学および生物物理学的分析で観察した内容を確認しました。
フリードマン氏は、最も基本的なレベルで、この研究はなぜチューブリンがTRiCの支援なしでは折りたためないのかという長年の謎を解決したと述べた。 「人間の細胞内でタンパク質がどのように折り畳まれるかを理解する新しい方法を最終的にもたらしたという点で、まさにゲームチェンジャーです。」
スパゲッティを花のように折る
タンパク質は、細胞が行う事実上すべてのことにおいて重要な役割を果たしており、タンパク質がどのように最終的な 3D 状態に折り畳まれるかを解明することは、化学および科学において最も重要な探求の XNUMX つです。 生物学.
チウさんの言う通り、 「タンパク質はスパゲッティのような一連のアミノ酸として始まりますが、適切な形の花に折り畳まれるまで機能しません。」
1950年代半ば以来、タンパク質がどのように折りたたまれるかについての私たちのイメージは、国立衛生研究所の研究者クリスチャン・アンフィンセンによって小さなタンパク質を使用して行われた実験によって形づくられてきました。彼は、小さなタンパク質を折り畳むと、自然に同じ形状に戻ることを発見し、そのための指示がタンパク質のアミノ酸配列にコード化されていると結論付けました。アンフィンセンは 1972 年のノーベル賞を共同受賞した。 化学 この発見のために。
30年後、研究者らは特殊な細胞機械がタンパク質の折り畳みを助けていることを発見した。しかし、それらの機能は、タンパク質が閉じ込められたり、固まったりするのを防ぎ、タンパク質が自発的に折りたたまれるのを助けることに限定されているという考え方が一般的でした。
シャペロニンと呼ばれるヘルパーマシンの一種には、折りたたまれながら内部にタンパク質を保持する樽状の部屋が含まれています。 TRiC はこのカテゴリーに当てはまります。
TRiC チャンバーは、2 つの積み重ねられたリングを形成する 8 つの異なるサブユニットで構成されるという点で独特です。チューブリンタンパク質の長く細い鎖は、クラゲのような形をしたヘルパー分子によってチャンバーの開口部に送られます。その後、チャンバーの蓋が閉まり、折り畳みが始まります。完了すると、蓋が開き、完成した折りたたまれたチューブリンが残ります。
チューブリンはTRiCなしでは折りたたむことができないため、TRiCはチューブリンの自発的な折りたたみを受動的に助ける以上の働きをしているように見えました。しかし、それは具体的にどのように機能するのでしょうか?この新しい研究はその疑問に答え、少なくともチューブリンなどのタンパク質については「自発的な折り畳み」の概念が当てはまらないことを示しています。代わりに、TRiC は、正しい形状のタンパク質につながるフォールディング経路を直接調整します。
フリードマン氏によると、人工知能(AI)の最近の進歩は、ほとんどのタンパク質の完成した折り畳まれた構造を予測できるが、AIはタンパク質がどのように正しい形状に達するのかを示していないという。この知識は、細胞のフォールディングを制御し、フォールディング疾患の治療法を開発するための基礎となります。この目標を達成するには、研究者は細胞内で起こる折り畳みプロセスの詳細な手順を解明する必要があります。
細胞室が担当する
10 年前、フリードマン、チウ、および彼らの研究チームは、TRIC チャンバー内で何が起こっているのかをさらに詳しく調査することにしました。
「細菌のシャペロニンの単純な折り畳み室と比較すると、人間の細胞のTRiCは非常に興味深く複雑な機械です。」 フリードマン氏は語った。 「その 8 つのサブユニットはそれぞれ異なる特性を持ち、チャンバー内で異なる表面を示します。これが非常に重要であることが判明しました。」
科学者らは、このユニークな部屋の内部が 2 つの方法で折り畳みプロセスを制御していることを発見しました。

(ジャオ・ヤンヤン/スタンフォード大学)
タンパク質の上でチャンバーの蓋が閉じると、内壁に静電気が帯電した領域が現れます。それらは、チューブリンタンパク質鎖の反対に帯電した部分を引き付け、基本的にそれらを壁に貼り付けて、折り畳みの次のステップに適した形状と構成を作成します。一方、チャンバー壁からぶら下がっているTRiCサブユニットの「尾」は、特定の時間と場所でチューブリンタンパク質を掴み、固定して安定化させます。
まず、チューブリンストランドの一端を壁の小さなポケットに引っ掛けて折ります。次に、もう一方の端が別の場所に取り付けられ、大きなループが作成されます。ループは、最初に折り畳まれた領域のすぐ隣に来るように折り畳まれます。
ステップ 3 では、中央セクションの一部が折りたたまれてタンパク質のコアと、細胞の働きに動力を与えるエネルギーを貯蔵および放出する分子である GTP が接続できるポケットが形成されます。
最後に、残りのタンパク質セクションが折りたたまれます。これで、チューブリン分子が作用する準備が整いました。
「折り畳みシーケンスの中間段階のこれらの構造スナップショットは、これまで極低温電子顕微鏡で観察されたことがありません。」 フリードマン氏は語った。
強力なテクニックの融合
彼女のチームは、何年にもわたる作業を必要とした一連の挑戦的な生化学的および生物物理学的テストによって、折り畳みシーケンスを確認しました。
これらの結果を解釈することで、研究者らは、TRiC チャンバー内で折り畳まれるときに変化するチューブリンの形状の画像を構築することができ、これはクライオ EM によって生成された画像と一致しました。
「これらの技術を行ったり来たりできるのは非常に強力です。そうすれば、目に見えるものが細胞内で何が起こっているかを反映していることが実際にわかるからです。」 フリードマン氏は語った。
「科学は、私が予測できなかった非常に興味深い解決策を示して私たちを驚かせました。」
この研究はまた、この折り畳みシステムが植物、動物、人間を構成する真核細胞でどのように進化したが、細菌や古細菌のような単純な細胞ではそうではなかったのかを理解する手がかりも提供する。真核細胞のニーズを満たすためにタンパク質がますます複雑になるにつれて、ある時点で、少しの助けがなければ、より複雑な仕事を実行するために必要な形状に折りたたむことができなくなったと研究者らは示唆しています。真核生物のタンパク質とそのシャペロニン室はおそらく一緒に進化し、おそらく約 2.7 億年前のすべての真核生物の最後の共通祖先から始まったと考えられます。
分析の複雑さとパンデミックの影響で、この研究は長期間にわたって行われ、研究に携わった多くの人々が他の仕事に移った。彼らには、プロジェクトの生化学的部分を実行して推進したフリードマン氏のグループの博士研究員ダニエル・ゲスタウト氏とミランダ・コリアー氏、冷凍実験を行ったチウ氏のグループのヤンヤン・チャオ氏、スンフン・ロー氏、ボックスエ・マー氏、グレッグ・ピンティリー氏が含まれる。 -EM分析。追加の寄稿者には、盧氏のグループの学生であるジュンスン・パーク氏と、スイスのチューリッヒにある工科大学のアレクサンダー・ライトナー氏が含まれていた。
この研究は、NIHからWah Chiu氏とJudith Frydman氏への助成金と、韓国国立研究財団とSuh Kyungbae Foundation (SUHF)から現在ソウル国立大学助教授であるSoung-Hun Roh氏への助成金によって支援された。
Journal Reference
- Daniel Gestaut et al.、ヒトシャペロニンTRiC/CCTによって指示されるチューブリン折り畳み経路の構造視覚化。 セル、8 年 2022 月 XNUMX 日 DOI: 10.1016 / j.cell.2022.11.014