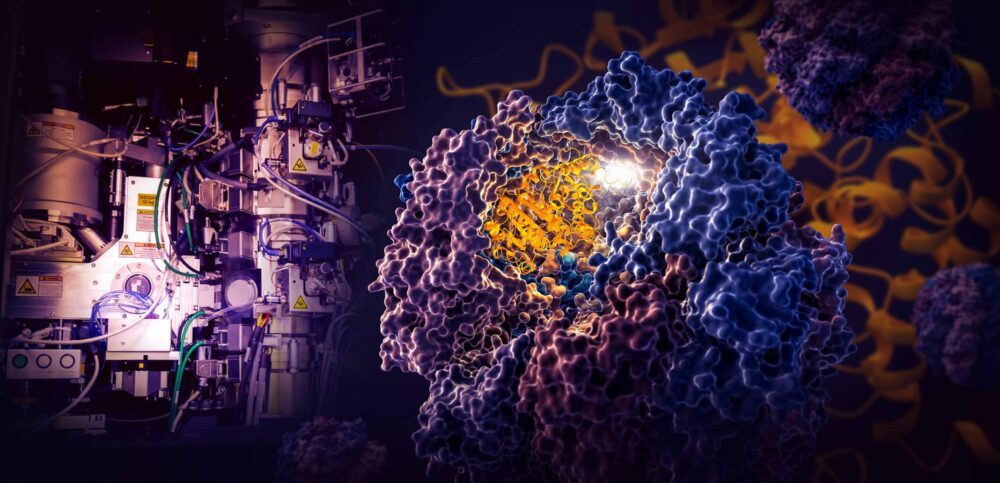
에너지부 산하 SLAC 국립 가속기 연구소(SLAC National Accelerator Laboratory)와 스탠포드 대학교 연구원들이 진행한 획기적인 연구에서는 TRiC라고 불리는 작은 세포 기계가 세포의 비계 및 수송 시스템 역할을 하는 미세소관의 구성 요소인 인간 단백질인 튜불린의 접힘을 어떻게 지시하는지를 보여줍니다. .
지금까지 과학자들은 TRiC 및 샤페로닌으로 알려진 유사한 기계가 접힘에 도움이 되는 환경을 수동적으로 제공하지만 직접적으로 참여하지는 않는다고 생각했습니다.
우리 세포와 식물과 동물의 단백질 중 최대 10%가 최종 활성 형태로 접히는 과정에서 이 작은 방에서 직접적인 도움을 받는 것으로 연구진은 추정했습니다.
TRiC의 도움으로 접히는 많은 단백질은 특정 암과 파킨슨병, 헌팅턴병, 알츠하이머병과 같은 신경퇴행성 질환을 포함한 인간 질병과 밀접하게 연관되어 있다고 이번 연구의 주요 저자 중 한 명인 스탠포드 교수 Judith Frydman이 말했습니다.
실제로 그녀는 많은 항암제가 세포 분열에 매우 중요한 튜불린과 이것이 형성하는 미세소관을 파괴하도록 설계되었다고 말했습니다. 따라서 TRiC를 이용한 튜불린 접힘 과정을 표적으로 삼는 것은 매력적인 항암 전략을 제공할 수 있습니다.
팀은 10년 간의 연구 결과를 다음 논문에 발표했습니다. 세포 .
"이것은 제가 40년 경력 동안 연구한 것 중 가장 흥미로운 단백질 구조입니다." 극저온 전자현미경(cryo-EM) 개발 및 사용의 선구자이자 SLAC의 극저온 EM 및 바이오이미징 부문 책임자인 SLAC/스탠포드 교수 Wah Chiu가 말했습니다.
“20년 전 주디스를 만났을 때,” 그는 말했다, “우리는 단백질이 접히는 것을 볼 수 있는지에 대해 이야기했습니다. 그것은 사람들이 수년 동안 하려고 노력해 왔고 이제 우리가 해냈습니다.”
연구자들은 극저온 전자현미경(cryo-EM)을 사용하여 원자에 가까운 분해능으로 TRiC가 지시하는 접힘 과정의 네 가지 뚜렷한 단계를 포착하고 생화학적 및 생물물리학적 분석을 통해 본 내용을 확인했습니다.
Frydman은 가장 기본적인 수준에서 이 연구는 TRiC의 도움 없이는 튜불린이 접힐 수 없는 이유에 대한 오랜 수수께끼를 해결했다고 말했습니다. "마침내 인간 세포에서 단백질이 어떻게 접히는지 이해하는 새로운 방법을 가져온 것은 정말 판도를 바꾸는 일이었습니다."
스파게티를 꽃으로 접기
단백질은 세포가 하는 거의 모든 일에서 필수적인 역할을 하며, 단백질이 어떻게 최종 3D 상태로 접히는지 알아내는 것은 화학과 과학 분야에서 가장 중요한 탐구 중 하나입니다. 생물학.
치우의 말대로, “단백질은 스파게티처럼 보이는 일련의 아미노산으로 시작하지만, 딱 맞는 모양의 꽃으로 접힐 때까지는 기능을 할 수 없습니다.”
1950년대 중반부터 미국 국립보건원(National Institutes of Health) 연구원 Christian Anfinsen이 작은 단백질을 사용하여 수행한 실험을 통해 단백질이 어떻게 접히는지에 대한 그림이 형성되었습니다. 그는 작은 단백질을 펼치면 그것이 저절로 같은 모양으로 되돌아온다는 사실을 발견했고, 그 지시가 단백질의 아미노산 서열에 코딩되어 있다고 결론지었습니다. 안핀센은 1972년 노벨상을 공동 수상했습니다. 화학 이 발견을 위해.
30년 후, 연구자들은 특수한 세포 기계가 단백질 접힘을 돕는다는 사실을 발견했습니다. 그러나 그 기능은 단백질이 갇히거나 함께 흐려지는 것을 방지함으로써 단백질이 자발적으로 접히는 것을 돕는 것으로 제한된다는 것이 널리 퍼져 있는 견해였습니다.
샤페로닌(chaperonin)이라고 불리는 도우미 기계의 한 유형에는 단백질이 접히는 동안 내부에 단백질을 보관하는 통 모양의 챔버가 포함되어 있습니다. TRiC이 이 범주에 속합니다.
TRiC 챔버는 두 개의 스택 링을 형성하는 8개의 서로 다른 하위 단위로 구성되어 있다는 점에서 독특합니다. 길고 얇은 튜불린 단백질 가닥이 해파리 모양의 보조 분자에 의해 챔버의 입구로 전달됩니다. 그런 다음 챔버의 뚜껑이 닫히고 접기가 시작됩니다. 완료되면 뚜껑이 열리고 완성된 접힌 튜불린 잎이 나옵니다.
튜불린은 TRiC 없이 접힐 수 없기 때문에 TRiC는 튜불린이 자발적으로 접히도록 수동적으로 돕는 것 이상의 역할을 할 수 있는 것으로 나타났습니다. 그런데 그게 정확히 어떻게 작동하는 걸까요? 이 새로운 연구는 그 질문에 답하고 적어도 튜불린과 같은 단백질의 경우 "자발적 접힘" 개념이 적용되지 않음을 보여줍니다. 대신, TRiC는 올바른 모양의 단백질로 이어지는 접힘 경로를 직접 조정합니다.
최근 인공 지능(AI)의 발전으로 대부분의 단백질의 완성되고 접힌 구조를 예측할 수 있지만 AI는 단백질이 어떻게 올바른 모양을 얻는지 보여주지 못한다고 프리드먼은 말했습니다. 이 지식은 세포의 접힘을 제어하고 접힘 질환에 대한 치료법을 개발하는 데 기본입니다. 이 목표를 달성하기 위해 연구자들은 세포에서 발생하는 접힘 과정의 세부 단계를 파악해야 합니다.
셀룰러 챔버가 담당합니다.
10년 전, Frydman, Chiu 및 그들의 연구팀은 TRIC 챔버에서 무슨 일이 일어나고 있는지 더 깊이 조사하기로 결정했습니다.
"박테리아에 있는 샤페로닌의 단순한 접힘 챔버와 비교할 때 인간 세포의 TRiC는 매우 흥미롭고 복잡한 기계입니다." 프리드먼이 말했다. "8개의 하위 단위 각각은 서로 다른 특성을 가지며 챔버 내부에 뚜렷한 표면을 제공하며 이는 매우 중요한 것으로 밝혀졌습니다."
과학자들은 이 독특한 방의 내부가 두 가지 방식으로 접히는 과정을 지시한다는 것을 발견했습니다.

(자오옌얀/스탠포드 대학교)
챔버의 뚜껑이 단백질 위로 닫히면 정전기 전하 영역이 내부 벽에 나타납니다. 그들은 튜불린 단백질 가닥의 반대 전하를 띤 부분을 끌어당겨 벽에 고정시켜 접는 다음 단계를 위한 적절한 모양과 구성을 만듭니다. 한편, 챔버 벽에 매달려 있는 TRiC 서브유닛 "꼬리"는 특정 시간과 장소에서 튜불린 단백질을 붙잡아 고정하고 안정화시킵니다.
시작하려면 튜불린 가닥의 한쪽 끝을 벽의 작은 주머니에 걸어 접습니다. 그런 다음 다른 쪽 끝을 다른 지점에 부착하여 큰 고리를 만듭니다. 루프는 첫 번째 접힌 영역 바로 옆에 가져오는 방식으로 접힙니다.
3단계에서는 중간 부분의 일부가 접혀서 단백질의 핵심을 형성하고, 세포 작업에 전력을 공급하기 위해 에너지를 저장하고 방출하는 분자인 GTP가 연결될 수 있는 포켓을 형성합니다.
마지막으로 나머지 단백질 부분이 접힙니다. 이제 튜불린 분자가 작용할 준비가 되었습니다.
"접힘 순서의 중간 단계에 대한 이러한 구조적 스냅샷은 저온전자현미경으로 이전에 본 적이 없습니다." 프리드먼이 말했다.
강력한 기술의 혼합
그녀의 팀은 수년간의 작업이 필요한 일련의 생화학적, 생물리학적 테스트를 통해 접힘 순서를 확인했습니다.
연구진은 이러한 결과를 해석하여 TRiC 챔버 내부에서 튜불린이 접힐 때 모양이 변하는 그림을 만들 수 있었는데, 이는 cryo-EM에서 생성된 이미지와 일치했습니다.
"이 기술들 사이를 왔다 갔다 할 수 있다는 것은 매우 강력합니다. 그렇게 하면 당신이 보는 것이 세포에서 일어나는 일을 반영한다는 것을 실제로 알 수 있기 때문입니다." 프리드먼이 말했다.
"과학은 내가 예상하지 못했던 정말 흥미로운 해결책으로 우리를 놀라게 했습니다."
이 연구는 또한 식물, 동물, 인간을 구성하는 진핵 세포에서 이러한 접힘 시스템이 어떻게 진화했는지 이해하는 단서를 제공하지만 박테리아나 고세균과 같은 단순한 세포에서는 그렇지 않습니다. 진핵세포의 필요를 충족시키기 위해 단백질이 점점 더 복잡해짐에 따라, 연구자들은 어떤 시점에서는 약간의 도움 없이는 더 복잡한 작업을 수행하는 데 필요한 모양으로 접힐 수 없다고 제안합니다. 진핵생물의 단백질과 샤페로닌실은 함께 진화했을 가능성이 크며, 아마도 약 2.7억년 전 모든 진핵생물의 마지막 공통조상에서 시작했을 것입니다.
분석의 복잡성과 전염병의 막간으로 인해 연구가 너무 오랫동안 진행되어 해당 연구에 참여한 많은 사람들이 다른 직업으로 옮겼습니다. 여기에는 프로젝트의 생화학적 부분을 수행하고 추진한 Frydman 그룹의 박사후 연구원 Daniel Gestaut와 Miranda Collier, 냉동 작업을 수행한 Chiu 그룹의 Yanyan Zhao, Soung-Hun Roh, Boxue Ma, Greg Pintilie가 포함됩니다. -EM 분석. 추가 기여자에는 노무현 그룹의 학생인 박준선과 스위스 취리히 ETH의 Alexander Leitner가 포함되었습니다.
이 연구는 NIH의 Wah Chiu와 Judith Frydman의 지원과 한국연구재단과 서경배재단(SUHF)의 현재 서울대학교 조교수인 노성훈의 지원을 받았습니다.
저널 참조
- Daniel Gestaut et al., 인간 샤페로닌 TRiC/CCT에 의해 지시되는 튜불린 접힘 경로의 구조적 시각화. 세포, 8년 2022월 XNUMX일 DOI: 10.1016 / j.cell.2022.11.014