먼지 입자보다 2500~10,000배 작은 자체 추진 방사성 동위원소로 덮인 입자 군대가 몸에 주입되면 암성 종양을 찾아서 부착하여 파괴한다고 상상해 보십시오. 공상 과학 소설처럼 들리나요? 방광암에 걸린 쥐의 경우에는 그렇지 않습니다.
스페인의 연구자들은 방사성 요오드를 함유하고 요소와 반응하여 스스로 추진하는 나노입자가 암성 방광 종양과 건강한 조직을 구별하는 능력을 가지고 있다고 보고했습니다. 이러한 "나노봇"은 종양의 세포외 기질에 침투하여 그 안에 축적되어 방사성 핵종 치료법이 정확한 목표에 도달할 수 있게 해줍니다. 에서 실시한 연구에서는 카탈루냐 생명공학 연구소 (IBEC)에 따르면 바르셀로나에서 이 치료법을 단회 투여받은 쥐는 치료받지 않은 동물에 비해 방광 종양 크기가 90% 감소했습니다.
이 새로운 접근법은 언젠가 방광암 치료에 혁명을 일으킬 수 있습니다. 방광암은 세계에서 600,000번째로 흔한 암으로, 세계보건기구(WHO)의 글로벌 암 관측소(Global Cancer Observatory)에 따르면 2022년에 220,000명 이상의 새로운 사례가 진단되고 전 세계적으로 XNUMX명 이상의 사망자가 발생했습니다.
전체 사례의 75%를 차지하는 비근육침습성 방광암은 현재 종양 절제술 후 화학요법이나 면역요법 약물을 방광에 주사하는 방식으로 치료되고 있다. 그러나 요로 상피(요로 내부를 감싸는 조직)의 낮은 투과성, 소변의 내용물 충전 및 그에 따른 약물 세척으로 인해 약물 전달이 특히 어렵습니다. 약물이 방광벽의 모든 면에 도달할 수 있도록 엎드려 누워 있는 동안 간격을 두고 몸을 돌려야 하기 때문에 이 과정은 환자에게도 불편합니다. 치료 후 30년 이내에 재발할 위험은 70~XNUMX%입니다.
임상 결과를 개선하기 위해 연구책임자는 사무엘 산체스 연구진은 혁신적이고 보다 효과적인 방광암 치료법을 개발하고 그 과정에서 재발률을 줄이는 것을 목표로 하고 있습니다. 또한, 단일 용량 치료법은 현재 14~XNUMX건의 입원이 필요한 치료 비용을 크게 줄일 수 있습니다.
연구팀은 표면에 다양한 기능적 구성 요소가 있는 메조다공성 실리카 나노입자로 나노봇을 만들었습니다. 여기에는 PET 시각화 또는 방사성 핵종 치료를 위한 방사성 동위원소와 소변의 요소와 반응하여 나노봇의 추진을 가능하게 하는 단백질 우레아제가 포함됩니다.
글쓰기 자연 나노 기술연구진은 300mM 요소를 함유한 용액에 나노봇 방울을 추가했을 때 나노봇이 떼지어 움직이는 움직임을 보여 활발하고 활발한 전면과 XNUMX차원 소용돌이를 형성했다고 보고했습니다. 요소가 없으면 나노봇은 단순히 첨가 지점 근처에 침전됩니다.
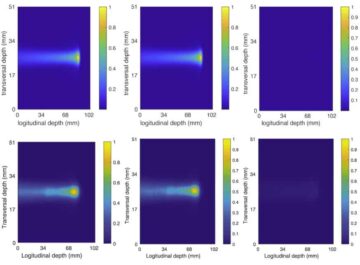
나노봇이 종양에 도달할 수 있는지 확인하기 위해 생체내에서, 팀은 종양이 있는 쥐의 행동을 평가했습니다. 양전자방출단층촬영(PET) 이미지는 MRI를 통해 측정한 바와 같이 방사성 표지된 나노봇의 신호가 종양 위치와 같은 위치에 있으며 방사능이 주로 표적 종양 부위에서 나타나는 것을 보여주었습니다. 나노봇과 요소를 주입한 쥐만이 종양 덩어리에 상당한 축적을 보였습니다. 물에 전달된 나노봇과 물이나 요소에 전달된 대조 나노입자(요소 분해 효소 없음)는 최소한의 종양 흡수를 나타냈습니다.
연구자들은 나노봇의 이동성이 종양 덩어리에 침투하는 데 도움이 된다고 제안합니다. "나노봇에는 종양을 인식하는 특정 항체가 부족하며 종양 조직은 일반적으로 건강한 조직보다 단단하지만 방광 종양의 경우는 그렇지 않습니다."라고 공동 저자는 설명합니다. 메리트셀 세라 카사블랑카스 IBEC의. “우리는 이러한 나노로봇이 자체 추진 화학 반응을 통해 pH를 국부적으로 증가시켜 종양의 세포외 기질을 분해할 수 있다는 것을 관찰했습니다. 이 현상은 더 큰 종양 침투를 선호했습니다.” 연구자들은 나노봇이 마치 벽인 것처럼 요로상피와 충돌하지만 더 해면질인 종양을 관통한다고 믿습니다.
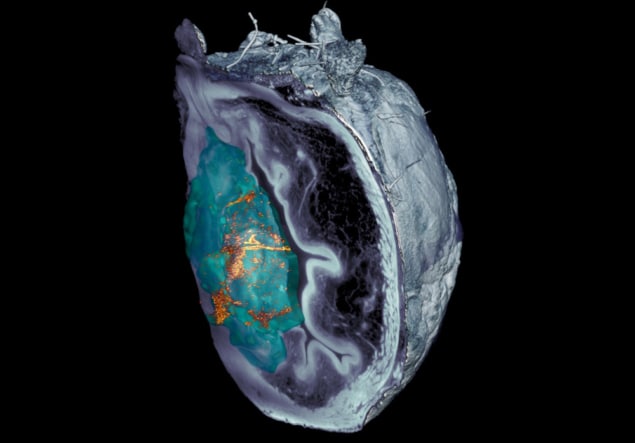
팀은 해부된 조직의 현미경 이미지에서 나노봇을 식별하는 것이 어려웠다고 지적했습니다. 공초점 광학 현미경 기술이 실패한 후, 연구진은 IRB 바르셀로나 평면 레이저 조명을 기반으로 방광의 다양한 층을 스캔하고 전체 기관의 3D 재구성을 생성할 수 있는 광시트 기반 현미경 시스템을 개발했습니다.
"우리가 개발한 산란형 탄성 광시트 현미경 시스템을 사용하면 종양 자체에서 반사되는 빛을 제거할 수 있어 사전 라벨링 없이 전례 없는 해상도로 장기 전체에서 나노입자를 식별하고 찾을 수 있습니다."라고 말합니다. 줄리앙 콜롬벨리 IRB 바르셀로나 출신.

조작된 박테리아는 암을 죽이는 방사성 동위 원소를 종양으로 유인합니다.
이 기술의 치료 효과를 평가하기 위해 연구팀은 요오드-131로 나노봇에 라벨을 붙였습니다.131I(방사성 핵종 치료에 일반적으로 사용되는 방사성 동위원소)을 종양이 있는 쥐에게 투여했습니다. 감량 용량을 이용한 치료 131요소를 함유한 I-나노봇은 종양 성장을 억제하는 반면 고용량은 131요소를 투여한 I-나노봇은 치료받지 않은 동물에 비해 종양 부피가 거의 90% 감소했습니다.
산체스는 말한다 물리 세계 팀의 다음 단계는 현재 화학 요법에 사용되는 소형 약물을 캡슐화하고 약물 운반체로서 나노봇의 효율성을 계속 테스트하는 것입니다. 그들은 결국 나노봇의 규모를 확대하고 규제 경로를 연구하여 IBEC 스핀오프를 통해 향후 3~4년 내에 첫 번째 임상 시험을 향해 나아갈 계획입니다. 나노봇 치료제.
- SEO 기반 콘텐츠 및 PR 배포. 오늘 증폭하십시오.
- PlatoData.Network 수직 생성 Ai. 자신에게 권한을 부여하십시오. 여기에서 액세스하십시오.
- PlatoAiStream. 웹3 인텔리전스. 지식 증폭. 여기에서 액세스하십시오.
- 플라톤ESG. 탄소, 클린테크, 에너지, 환경, 태양광, 폐기물 관리. 여기에서 액세스하십시오.
- PlatoHealth. 생명 공학 및 임상 시험 인텔리전스. 여기에서 액세스하십시오.
- 출처: https://physicsworld.com/a/self-propelling-nanobots-shrink-bladder-tumours-in-mice-by-90/
- :이다
- :아니
- $UP
- 000
- 10
- 135
- 14
- 2022
- 220
- 300
- 3d
- 600
- a
- 능력
- 에 따르면
- 계정
- 모으다
- 축적
- 활동적인
- 추가
- 또한
- 또한
- 관리 된
- 후
- 겨냥
- All
- 허용
- 또한
- an
- 및
- 동물
- 접근
- 있군요
- 육군
- 체포 된
- AS
- 평가
- At
- 붙이다
- 유치
- 저자
- 박테리아
- 바르셀로나
- 기반으로
- 행동
- 믿으세요
- 사이에
- 기관
- 몸
- 흩어져
- 비자 면제 프로그램에 해당하는 국가의 시민권을 가지고 있지만
- by
- CAN
- 게자리
- 수
- 캐리어
- 케이스
- 가지 경우
- 도전
- 화학
- 객관적인
- 임상 시험
- 동료
- 충돌
- COM
- 공통의
- 일반적으로
- 비교
- 구성 요소들
- 실시
- 함유량
- 계속
- 제어
- 비용
- 만든
- 만들기
- 현재
- 일
- 사망
- 전달
- 배달
- 결정된
- 개발
- 개발
- 다른
- 드러내다
- 선량
- 아래 (down)
- 마약
- 약물
- 두
- 먼지
- 효과
- 유효한
- 효율성
- 제거
- 방사
- 가능
- 사용 가능
- 수
- 가능
- 전체의
- EU
- 평가
- 있을뿐만 아니라
- 검토하다
- 전시품
- 설명
- 실패한
- 소설
- 충전재
- 먼저,
- 다섯
- 다음에
- 수행원
- 럭셔리
- 사
- 에
- 기능의
- 글로벌
- 세계적으로
- 큰
- 성장
- 했다
- 있다
- 건강
- 건강은 물론, 경제성까지!
- 도움이
- 그러나
- HTTPS
- 확인
- 식별
- if
- 형상
- 면역 요법
- 개선
- in
- 포함
- 증가
- 정보
- 혁신적인
- 내부
- 의도
- 으로
- 발행물
- IT
- 그
- 그 자체
- JPG
- 라벨
- 결핍
- 레이저
- 레이어
- 지도
- 빛
- 처럼
- 알맹이
- 장소 상에서
- 낮은
- 질량
- 매트릭스
- 최대 폭
- XNUMX월..
- 현미경 사용
- 최소의
- 유동성
- 배우기
- 가장
- 운동
- 움직임
- MRI
- 자연
- 가까운
- 거의
- 필요
- 신제품
- 다음 것
- 주의
- 소설
- 전망대
- of
- on
- ONE
- 만
- or
- 결과
- 위에
- 특별히
- 경로
- 환자
- 침투
- 현상
- 물리학
- 물리 세계
- 플라톤
- 플라톤 데이터 인텔리전스
- 플라토데이터
- ...을 더한
- 위치
- 정확한
- 주로
- 교장
- 이전에
- 방법
- 추진력
- 추진
- 단백질
- 거주비용
- 도달
- 반응
- 반응
- 전수
- 인정하다
- 회귀
- 감소
- 축소
- 반영
- 규정하는
- 신고
- 필요
- 연구원
- 분해능
- 혁명적 인
- 위험
- 라고
- 규모
- 스캐닝
- 흩어져있는
- 과학
- 공상 과학 소설
- 검색
- 본
- 보여
- 뒷면
- 신호
- 크게
- 간단히
- 단일
- 대지
- SIX
- 크기
- 작은
- 작은
- So
- 해결책
- 소리
- 스페인
- 구체적인
- 단계
- 교육과정
- 후속의
- 실질적인
- 제안
- 체계
- 목표
- 팀
- 기법
- 말하다
- test
- 보다
- 그
- XNUMXD덴탈의
- 세계
- 그들의
- 그들
- 그들 자신
- 요법
- Bowman의
- 그들
- 이
- 세
- 삼차원의
- 을 통하여
- 도처에
- 미리보기
- 시대
- 에
- 에 대한
- 처리 된
- 치료
- 트리 트먼트
- 시련
- 참된
- 회전
- 일반적으로
- 전례가없는
- ...에
- 이해
- us
- 익숙한
- 여러
- 를 통해
- 심상
- 음량
- 벽
- 였다
- 물
- we
- 했다
- 언제
- 여부
- 어느
- 동안
- 과
- 이내
- 없이
- 세계
- 겠지
- 년
- 제퍼 넷