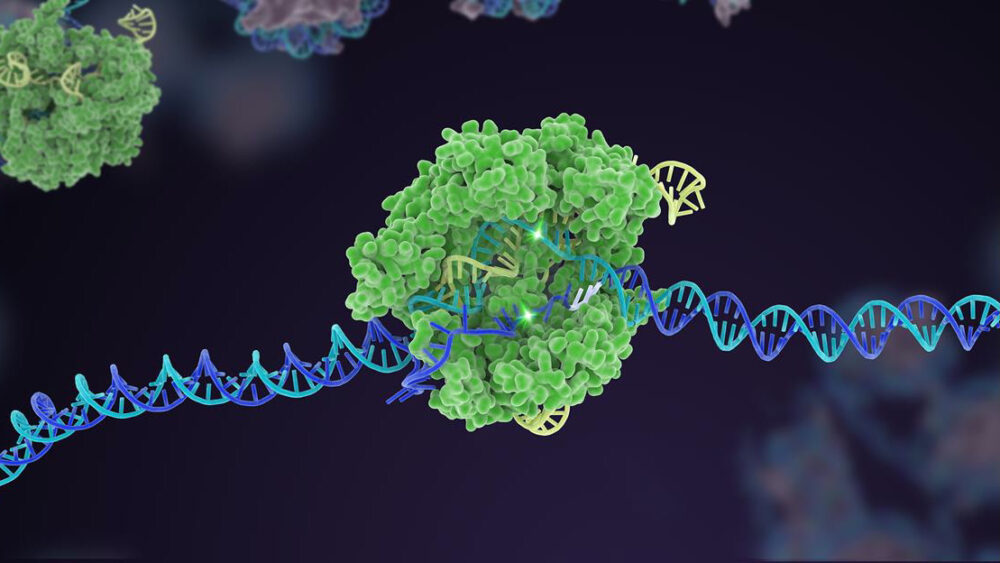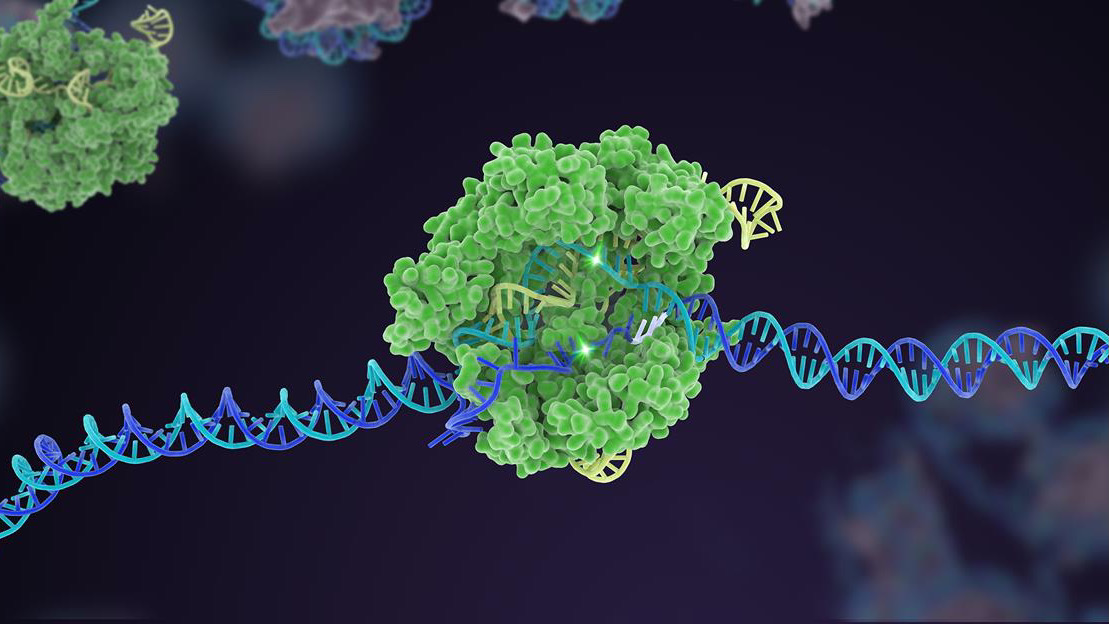
Tien jaar geleden schoot een weinig bekend bacterieel verdedigingsmechanisme omhoog naar roem als een krachtige genoombewerker. In het decennium daarna heeft CRISPR-Cas9 meerdere varianten voortgebracht, die zich hebben uitgebreid tot een uitgebreide toolbox die de genetische code van het leven kan bewerken.
Verre van een achtervolging in een ivoren toren, kwam het praktische gebruik ervan in onderzoek, gezondheidszorg en landbouw snel en furieus.
Je hebt de krantenkoppen gezien. De FDA keurde het gebruik ervan goed in het aanpakken van de onderliggende genetische mutatie voor sikkelcelziekte. Sommige onderzoekers bewerkte immuuncellen om onbehandelbare bloedkankers bij kinderen te bestrijden. Anderen namen orgaantransplantaties van varkens naar mensen van droom naar werkelijkheid in een poging het tekort aan donororganen te verlichten. Recent werk heeft tot doel miljoenen mensen met een hoog cholesterolgehalte te helpen - en mogelijk CRISPR-gebaseerde gentherapie bij de massa te brengen - door hun kans op hartaandoeningen verkleinen met een enkele injectie.
Maar voor Dr. Jennifer Doudna, die in 2020 de Nobelprijs won voor haar rol bij de ontwikkeling van CRISPR, zijn we nog maar aan het begin van het potentieel ervan. Samen met afgestudeerde student Joy Wang heeft Doudna een routekaart opgesteld voor het volgende decennium van de technologie in een artikel in Wetenschap.
Als de jaren 2010 gericht waren op het opzetten van de CRISPR-toolbox en het bewijzen van de effectiviteit ervan, bereikt de technologie in dit decennium zijn volledige potentieel. Van op CRISPR gebaseerde therapieën en grootschalige schermen voor ziektediagnostiek tot het ontwikkelen van gewassen met een hoge opbrengst en voedzaam voedsel, de technologie "en de potentiële impact ervan bevinden zich nog in de kinderschoenen", schreven de auteurs.
Een decennium van hoogtepunten
We hebben veel inkt gemorst over CRISPR-vooruitgang, maar het loont de moeite om het verleden opnieuw te bekijken om de toekomst te voorspellen - en onderweg mogelijk problemen te ontdekken.
Een vroeg hoogtepunt was het ongelooflijke vermogen van CRISPR om snel diermodellen van ziekten te ontwikkelen. De oorspronkelijke vorm knipt gemakkelijk een gericht gen weg in een zeer vroeg embryo, dat wanneer het in een baarmoeder wordt getransplanteerd, in slechts een maand genetisch gemodificeerde muizen kan genereren, vergeleken met een jaar met eerdere methoden. Aanvullende CRISPR-versies, zoals basisbewerking - het verwisselen van de ene genetische letter voor een andere - en prime-bewerking - waarbij het DNA wordt afgeknipt zonder beide strengen door te knippen - hebben de flexibiliteit van de toolkit bij het ontwerpen van genetisch gewijzigde organoïden verder vergroot (denk mini-hersenen) en dieren. CRISPR ontwikkelde snel tientallen modellen voor enkele van onze meest verwoestende en verbijsterende ziekten, waaronder verschillende vormen van kanker, de ziekte van Alzheimer en de spierdystrofie van Duchenne, een degeneratieve aandoening waarbij de spier langzaam wegkwijnt. Er zijn nu tientallen op CRISPR gebaseerde onderzoeken in de werken.
CRISPR versnelde ook genetische screening naar het big data-tijdperk. In plaats van zich op één gen tegelijk te richten, is het nu mogelijk om duizenden genen parallel het zwijgen op te leggen of te activeren, waardoor een soort Rosetta-steen wordt gevormd voor het vertalen van genetische verstoringen in biologische veranderingen. Dit is vooral belangrijk voor het begrijpen van genetische interacties, zoals die bij kanker of veroudering waar we voorheen niet bekend mee waren, en het verkrijgen van nieuwe munitie voor de ontwikkeling van geneesmiddelen.
Maar een bekroning voor CRISPR was de multiplexbewerking. Net als het gelijktijdig tikken op meerdere pianotoetsen, richt deze vorm van genetische manipulatie zich op meerdere specifieke DNA-gebieden, waardoor de genetische samenstelling van een genoom in één keer snel verandert.
De technologie werkt in planten en dieren. Eeuwenlang hebben mensen nauwgezet gewassen gekweekt met wenselijke kenmerken, of het nu gaat om kleur, grootte, smaak, voeding of ziekteresistentie. CRISPR kan helpen bij het selecteren op meerdere kenmerken of zelfs bij het temmen van nieuwe gewassen in slechts één generatie. CRISPR-gegenereerde hoornloze stieren, voedingsrijke tomaten, en hypergespierde boerderijdieren en vis zijn al realiteit. Met de wereldbevolking tegen 8 miljard in 2022 en miljoenen lijden honger, CRISPRed-gewassen kunnen een reddingslijn bieden - dat wil zeggen, als mensen bereid zijn de technologie te accepteren.
Het pad vooruit
Waar gaan we heen?
Volgens de auteurs moeten we de effectiviteit van CRISPR verder vergroten en vertrouwen opbouwen. Dit betekent teruggaan naar de basis om de bewerkingsnauwkeurigheid en precisie van de tool te vergroten. Hier zijn platforms om snel Cas-enzymen te ontwikkelen, de "schaar" -component van de CRISPR-machinerie, van cruciaal belang.
Successen zijn er al: één Cas-versie, bij voorbeeld, fungeert als een vangrail voor de doelcomponent - de sgRNA "bloedhond". In klassieke CRISPR werkt het sgRNA alleen, maar in deze bijgewerkte versie heeft het moeite om te binden zonder Cas-hulp. Deze truc helpt de bewerking af te stemmen op een specifieke DNA-site en verhoogt de nauwkeurigheid zodat de snede werkt zoals voorspeld.
Vergelijkbare strategieën kunnen ook de precisie verhogen met minder bijwerkingen of nieuwe genen inbrengen in cellen zoals neuronen en andere die niet langer delen. Hoewel het al mogelijk is met prime-bewerking, kan de efficiëntie dat wel zijn 30 keer lager dan klassieke CRISPR-mechanismen.
"Een belangrijk doel voor prime editing in het komende decennium is het verbeteren van de efficiëntie zonder de zuiverheid van het bewerkingsproduct in gevaar te brengen - een resultaat dat de potentie heeft om prime editing om te zetten in een van de meest veelzijdige tools voor precisiebewerking", aldus de auteurs.
Maar misschien nog belangrijker is de bevalling, die vooral voor de therapie een knelpunt blijft. Momenteel wordt CRISPR over het algemeen gebruikt op cellen buiten het lichaam die terug worden geïnfundeerd, zoals in het geval van CAR-T, of in sommige gevallen worden vastgemaakt aan een virale drager of ingekapseld in vetbellen en in het lichaam worden geïnjecteerd. Er zijn successen geboekt: in 2021, keurde FDA goed eerste op CRISPR gebaseerde opname om een genetische bloedziekte, transthyretine-amyloïdose, aan te pakken.
Toch zijn beide strategieën problematisch: niet veel soorten cellen kunnen de CAR-T-behandeling overleven - sterven wanneer ze opnieuw in het lichaam worden geïntroduceerd - en het richten op specifieke weefsels en organen blijft meestal onbereikbaar voor injecteerbare therapieën.
Een belangrijke vooruitgang voor het komende decennium, aldus de auteurs, is om de CRISPR-lading zonder schade naar het beoogde weefsel te brengen en de gen-editor op de beoogde plek vrij te geven. Elk van deze stappen, hoewel schijnbaar eenvoudig op papier, presenteert zijn eigen reeks uitdagingen die zowel bio-engineering als innovatie vereisen om te overwinnen.
Ten slotte kan CRISPR synergiseren met andere technologische ontwikkelingen, aldus de auteurs. Door bijvoorbeeld gebruik te maken van celbeeldvorming en machine learning, kunnen we binnenkort nog efficiëntere genoom-editors ontwikkelen. Dankzij snellere en goedkopere DNA-sequencing, kunnen we dan gemakkelijk de gevolgen van genbewerking volgen. Deze gegevens kunnen dan een soort feedbackmechanisme vormen waarmee nog krachtigere genoom-editors in een deugdzame lus kunnen worden geconstrueerd.
Impact in de echte wereld
Hoewel verdere uitbreiding van de CRISPR-toolbox op de agenda staat, is de technologie volwassen genoeg om de echte wereld in het tweede decennium te beïnvloeden, aldus de auteurs.
In de nabije toekomst zouden we moeten zien dat "een groter aantal op CRISPR gebaseerde behandelingen naar latere stadia van klinische onderzoeken gaat". Verder vooruitkijkend, zou de technologie, of zijn varianten, xenotransplantaties van varkens-naar-menselijke orgels routinematig kunnen maken in plaats van experimenteel. Grootschalige screenings op genen die leiden tot veroudering of degeneratieve hersen- of hartaandoeningen - onze topmoordenaars vandaag - kunnen profylactische op CRISPR gebaseerde behandelingen opleveren. Het is geen gemakkelijke taak: we hebben zowel kennis nodig van de genetica die ten grondslag ligt aan veelzijdige genetische ziekten - dat wil zeggen, wanneer meerdere genen een rol spelen - als een manier om de bewerkingstools aan hun doel te leveren. "Maar de potentiële voordelen kunnen innovatie op deze gebieden stimuleren die veel verder gaat dan wat vandaag mogelijk is", aldus de auteurs.
Maar met meer macht komt ook meer verantwoordelijkheid. CRISPR is razendsnel vooruitgegaan en regelgevende instanties en het publiek hebben nog steeds moeite om de achterstand in te halen. Misschien wel het meest beruchte voorbeeld was dat van de CRISPR-baby's, waar experimenten werden uitgevoerd tegen wereldwijde ethische richtlijnen voortgestuwd een internationaal consortium om een rode lijn uit te zetten voor het bewerken van menselijke geslachtscellen.
Evenzo blijven genetisch gemodificeerde organismen (GGO's) een controversieel onderwerp. Hoewel CRISPR veel nauwkeuriger is dan eerdere genetische hulpmiddelen, is het aan de consument om te beslissen of hij of zij welkom is een nieuwe generatie door mensen ontwikkeld voedsel-zowel plant als dier.
Dit zijn belangrijke gesprekken die een mondiaal discours nodig hebben terwijl CRISPR zijn tweede decennium ingaat. Maar voor de auteurs ziet de toekomst er rooskleurig uit.
"Net als tijdens de komst van CRISPR-genoombewerking, zal een combinatie van wetenschappelijke nieuwsgierigheid en de wens om de samenleving ten goede te komen het volgende decennium van innovatie in CRISPR-technologie stimuleren", zeiden ze. "Door de natuurlijke wereld te blijven verkennen, zullen we ontdekken wat we ons niet kunnen voorstellen en het in de echte wereld gebruiken ten behoeve van de planeet."
Krediet van het beeld: NIH
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- Platoblockchain. Web3 Metaverse Intelligentie. Kennis versterkt. Toegang hier.
- Bron: https://singularityhub.com/2023/01/25/crisprs-wild-first-decade-only-scratches-the-surface-of-its-potential/
- 2020
- a
- vermogen
- versneld
- ACCEPTEREN
- nauwkeurigheid
- prestatie
- Handelingen
- Extra
- bevorderen
- vergevorderd
- voorschotten
- komst
- tegen
- agentschappen
- agenda
- Veroudering
- landbouw
- vooruit
- wil
- verlichten
- alleen
- al
- Hoewel
- Alzheimer
- munitie
- en
- dier
- dieren
- goedgekeurd
- gebieden
- Hulp
- auteurs
- terug
- baseren
- De Basis
- voordeel
- betekent
- Berkeley
- Verder
- Groot
- Big data
- Miljard
- binden
- bloed
- Bloomberg
- lichaam
- boost
- Boosted
- Hersenen
- brengen
- bouw
- vertrouwen op te bouwen
- Kanker
- kan niet
- geval
- gevallen
- het worstelen
- Cellen
- uitdagingen
- kansen
- Wijzigingen
- veranderende
- goedkoper
- klassiek
- Klinisch
- klinische proeven
- code
- kleur
- combinatie van
- hoe
- vergeleken
- bestanddeel
- uitgebreid
- afbreuk te doen aan
- Gevolgen
- consortium
- Consumenten
- voortgezette
- controversieel
- conversaties
- kon
- Credits
- CRISPR
- kritisch
- gewassen
- nieuwsgierigheid
- Op dit moment
- Snijden
- snijdend
- gegevens
- decennium
- Verdediging
- leveren
- levering
- het ontwikkelen van
- Ontwikkeling
- Onthul Nu
- Ziekte
- ziekten
- dna
- beneden
- tientallen
- droom
- rit
- drug
- gedurende
- elk
- Vroeg
- gemakkelijk
- editor
- effectiviteit
- duurt
- doeltreffendheid
- doeltreffend
- ingekapseld
- ingenieur
- Engineering
- Komt binnen
- vooral
- gevestigd
- oprichting
- ethisch
- Zelfs
- ontwikkelen
- voorbeeld
- uit te breiden
- Verken
- FAME
- boerderij
- SNELLE
- FDA
- feedback
- vechten
- Voornaam*
- Flexibiliteit
- gericht
- voedsel
- formulier
- oppompen van
- vol
- verder
- toekomst
- met het verkrijgen van
- algemeen
- voortbrengen
- generatie
- gentechnologie
- Genetica
- Globaal
- Go
- doel
- gaan
- afstuderen
- meer
- richtlijnen
- Headlines
- gezondheidszorg
- Hart
- hulp
- helpt
- hier
- Hoge
- Markeer
- HTTPS
- menselijk
- Imaging
- Impact
- belangrijk
- het verbeteren van
- in
- Inclusief
- Laat uw omzet
- meer
- Verhoogt
- ongelooflijk
- Innovatie
- interacties
- Internationale
- IT
- Jennifer
- eentje maar
- sleutel
- toetsen
- moordenaars
- Soort
- kennis
- grootschalig
- leiden
- leren
- lenen
- letter
- Life
- Lijn
- langer
- op zoek
- LOOKS
- machine
- machine learning
- machinerie
- Hoofd
- maken
- make-up
- veel
- volwassen
- middel
- mechanisme
- methoden
- miljoenen
- modellen
- gewijzigd
- monitor
- Maand
- meer
- efficiënter
- meest
- bewegend
- veelzijdig
- meervoudig
- Naturel
- NATUUR
- Nabij
- Noodzaak
- neuronen
- New
- volgende
- NHS
- NIH
- Nobelprijs
- berucht
- aantal
- EEN
- origineel
- Overige
- Overig
- buiten
- Overwinnen
- het te bezitten.
- Papier
- Parallel
- verleden
- pad
- pays
- Mensen
- misschien
- vliegtuig
- Plants
- platforms
- Plato
- Plato gegevensintelligentie
- PlatoData
- Overvloed
- bevolking
- mogelijk
- potentieel
- mogelijk
- energie
- krachtige
- PRAKTISCH
- precisie
- voorspellen
- voorspeld
- cadeautjes
- vorig
- die eerder
- Prime
- prijs
- problemen
- Product
- zorgen voor
- publiek
- zetten
- snel
- bereiken
- Bereikt
- vast
- echte wereld
- Realiteit
- recent
- Rood
- regelgevers
- los
- blijven
- stoffelijk overschot
- vereisen
- onderzoek
- onderzoekers
- veerkracht
- verantwoordelijkheid
- Rijk
- roadmap
- Rol
- Zei
- Wetenschap
- Verkenner
- doorlichting
- schermen
- Tweede
- reeks
- schaarste
- moet
- kant
- Stilte
- Eenvoudig
- gelijktijdig
- sinds
- single
- website
- Maat
- Langzaam
- So
- Maatschappij
- sommige
- specifiek
- snelheid
- Spot
- gesponnen
- stadia
- Stappen
- Still
- STONE
- strategieën
- strijd
- Worstelen
- Student
- dergelijk
- zieken
- Oppervlak
- te overleven
- doelwit
- doelgerichte
- targeting
- doelen
- Taak
- technologisch
- Technologie
- De
- The Basics
- de wereld
- hun
- therapie
- duizenden kosten
- niet de tijd of
- keer
- naar
- vandaag
- samen
- Toolbox
- tools
- top
- onderwerp
- Tower
- proeven
- Trust
- BEURT
- types
- UN
- die ten grondslag liggen
- begrip
- bijgewerkt
- .
- divers
- veelzijdig
- versie
- welkom
- Wat
- Wat is
- of
- welke
- en
- WIE
- Wild
- wil
- gewillig
- zonder
- Won
- Mijn werk
- Bedrijven
- wereld
- jaar
- jaar
- Opbrengst
- zephyrnet