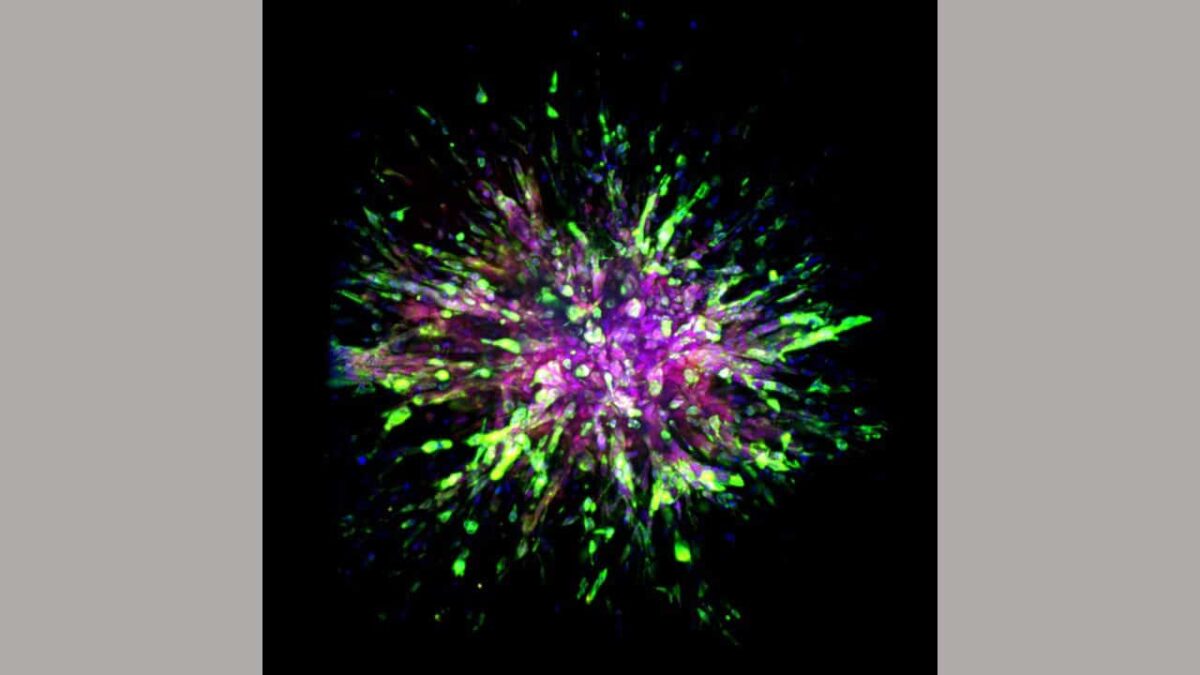
Triple-negatieve borstkanker (TNBC) is een agressief subtype geassocieerd met vroege metastatische recidief en slechtere patiëntresultaten. De tumor brengt moleculaire markers van de epitheliale-mesenchymale overgang tot expressie, maar de vereiste ervan tijdens spontane TNBC-metastase in vivo blijft onvolledig begrepen.
Wetenschappers uit Johns Hopkins Medicine hebben significante moleculaire variaties geïdentificeerd tussen kankercellen die zich vastklampen aan een initiële tumor en die welke zich verspreiden om verre tumoren te vormen.
Andrew Ewald, Ph.D., de Virginia DeAcetis Professor in Basic Science Research en directeur van de afdeling Celbiologie aan de Johns Hopkins University School of Medicine, zei: "We hebben al lang nieuwe behandeldoelen en opties nodig voor triple-negatieve borsten" kankers. Deze kankers keren vaak terug binnen drie jaar na diagnose, en behandelingen die voor andere borstkankers worden gebruikt, werken meestal niet voor triple-negative."
Wetenschappers voerden het onderzoek uit op muismodellen en menselijke weefsels. Deze vorm van kanker is bijzonder dodelijk omdat het moleculaire signalen op het oppervlak mist die verband houden met de hormonen progesteron en oestrogeen, evenals het kankerbevorderende eiwit Her2-neu. Meest borstkanker behandelingen richten zich tegenwoordig op die markers, waardoor ze niet effectief zijn voor mensen met triple-negatieve tumoren.
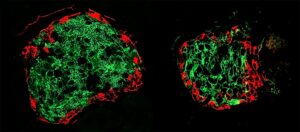
Wetenschappers observeerden in deze studie zorgvuldig moleculaire verschillen tussen initiële of primaire drievoudig-negatieve borstkankerlocaties en gebieden waar het zich verspreidde, of metastatische locaties, tussen drie verschillende soorten cellen: muismodellen, menselijke kankers geïmplanteerd in muizen en monsters van zowel primaire als metastatische weefsels van acht patiënten.
Met behulp van technieken zoals machine learning, cellulaire beeldvorming en biochemische analyse, identificeerden wetenschappers verschillen tussen de genomische expressiepatronen van de primaire en metastatische kankers.
Ewald zei, "Het slechte nieuws van onze studie is dat cellen van metastatische sites super geoptimaliseerd zijn voor migratie en weerstand bieden aan behandeling. Het goede nieuws is dat we verschillende eiwitten hebben geïdentificeerd die transcriptiefactoren worden genoemd en die deze cellen nodig hebben om de uitdagingen van migreren en bloeien op metastatische locaties aan te gaan. Mogelijk kunnen we nieuwe therapieën ontwerpen die zich richten op deze transcriptiefactoren."
Wetenschappers merkten verschillende onderscheidende kenmerken op in de cellen van muizen geïmplanteerd met menselijke triple-negatieve borstkankertumoren of muizen die waren aangepast om de muisversie van de ziekte te krijgen. Het belangrijkste was dat ze ontdekten dat invasie van triple-negatieve borstkankercellen naar andere weefsels van een ander deel van het lichaam, de cellen twee cellulaire eigenschappen krijgen: betere beweging en overleving.
Om dit te bereiken, verwerven borstkankercellen het cellulaire skeleteiwit vimentine, dat het vermogen van zogenaamde mesenchymale cellen om te migreren en nieuwe cellen te genereren verbetert. Mesenchymale cellen zijn een type cel dat over het algemeen in botten en beenmerg.
De productie van een eiwit genaamd cadherine biedt overlevingsvoordelen voor triple-negatieve borstkankercellen. Het eiwit wordt meestal aangetroffen in epitheelcellen die de kanalen en bedekkingen van organen bekleden en zichzelf vaak vernieuwen.
Wetenschappers classificeren hun cellulaire toestand als zogenaamde hybride epitheel-mesenchymale (EMT) cellen wanneer triple-negatieve borstkankercellen dergelijke overlevings- en migrerende eigenschappen krijgen.
Met de hulp van Elana Fertig, Ph.D., divisiedirecteur en associate director van kwantitatieve wetenschappen, en mededirecteur van het Convergence Institute van het Johns Hopkins Kimmel Cancer Center, observeerden wetenschappers zorgvuldig moleculen die betrokken zijn bij hybride EMT-toestanden. Ze volgden ook de moleculaire patronen van individuele cellen in celassays die invasie uit de primaire tumor en vorming van een kolonie op een metastatische plaats modelleren.
Onderzoekers gebruikten machine learning-technieken om patronen in de expressie van elke cel te identificeren RNA, een familielid van DNA dat betrokken is bij eiwitsynthese. De meeste metastatische cellen, ontdekten de onderzoekers, transformeren in de hybride EMT-staat, die meer migrerend en veerkrachtiger is. Vervolgens onderzochten wetenschappers primaire tumoren en weefsels van de metastatische locaties van dezelfde patiënten om vergelijkbare toestanden te valideren in monsters van acht patiënten met triple-negatieve maligniteiten.
Op moleculair niveau produceren de meeste metastatische cellen vijf eiwitten die transcriptiefactoren worden genoemd (Grhl2, Foxc2, Zeb1, Zeb2 en Ovol1) die het maken van eiwitten bevorderen die betrokken zijn bij kankercelinvasie of kolonievorming.
Ewald zei, "De moleculaire verschillen tussen uitgezaaide en primaire tumoren zijn waarschijnlijk de reden waarom uitgezaaide tumorcellen zo resistent zijn tegen de huidige behandelingen."
Wetenschappers bestuderen nu manieren om de genen van de transcriptiefactoren of hun resulterende eiwitten te blokkeren om de groei van uitgezaaide kanker te stoppen en of dezelfde moleculaire en cellulaire veranderingen plaatsvinden in andere kankers, zoals die in de dikke darm, bijnieren, maag en dunne darm.
Journal Reference:
- Eloise M. Grasset, Matthew Dunworth, et al. Triple-negatieve borstkankermetastase omvat complexe epitheliale-mesenchymale overgangsdynamiek en vereist vimentine. Science Translational Medicine DOI: 10.1126/scitranslmed.abn7571