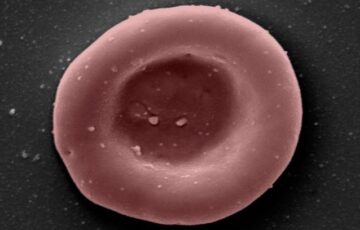
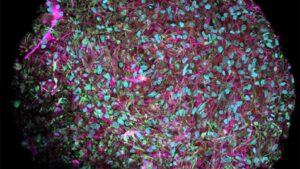
Het hele leven is opgebouwd uit cellen meerdere grootheden kleiner dan een korreltje zout. Hun ogenschijnlijk eenvoudig ogende structuren maskeren de ingewikkelde en complexe moleculaire activiteit die hen in staat stelt de functies uit te voeren die het leven in stand houden. Onderzoekers beginnen deze activiteit tot een detailniveau te visualiseren dat ze voorheen niet konden.
Biologische structuren kunnen worden gevisualiseerd door te beginnen op het niveau van het hele organisme en naar beneden te werken, of door te beginnen op het niveau van afzonderlijke atomen en omhoog te werken. Er is echter een resolutiekloof geweest tussen de kleinste structuren van een cel, zoals het cytoskelet dat de vorm van de cel ondersteunt, en de grootste structuren, zoals de ribosomen die eiwitten in cellen maken.
Naar analogie van Google Maps, terwijl wetenschappers hele steden en individuele huizen hebben kunnen zien, hadden ze niet de tools om te zien hoe de huizen samenkwamen om buurten te vormen. Het zien van deze details op buurtniveau is essentieel om te kunnen begrijpen hoe individuele componenten samenwerken in de omgeving van een cel.
Nieuwe tools overbruggen deze kloof gestaag. En voortdurende ontwikkeling van een bepaalde techniek, cryo-elektronentomografie of cryo-ET, heeft het potentieel om te verdiepen hoe onderzoekers bestuderen en begrijpen hoe cellen functioneren in gezondheid en ziekte.
Als de eerste hoofdredacteur van Wetenschap magazine en als een onderzoeker die decennialang moeilijk te visualiseren grote eiwitstructuren heeft bestudeerd, ben ik getuige geweest van verbazingwekkende vooruitgang in de ontwikkeling van hulpmiddelen die biologische structuren in detail kunnen bepalen. Net zoals het gemakkelijker wordt om te begrijpen hoe gecompliceerde systemen werken als je weet hoe ze eruit zien, is het begrijpen van hoe biologische structuren in een cel in elkaar passen de sleutel tot het begrijpen van hoe organismen functioneren.
Een korte geschiedenis van microscopie
In de 17e eeuw, lichtmicroscopie onthulde voor het eerst het bestaan van cellen. In de 20e eeuw bood elektronenmicroscopie nog meer details, waardoor de uitgebreide structuren binnen cellen, inclusief organellen zoals het endoplasmatisch reticulum, een complex netwerk van membranen die een sleutelrol spelen bij eiwitsynthese en -transport.
Van de jaren '1940 tot '1960 werkten biochemici aan het scheiden van cellen in hun moleculaire componenten en leerden ze hoe ze de 3D-structuren van eiwitten en andere macromoleculen konden bepalen met of bijna atomaire resolutie. Dit werd voor het eerst gedaan met behulp van röntgenkristallografie om de structuur van te visualiseren myoglobine, een eiwit dat zuurstof levert aan spieren.
In het afgelopen decennium zijn technieken gebaseerd op nucleaire magnetische resonantie, dat afbeeldingen produceert op basis van hoe atomen in een magnetisch veld op elkaar inwerken, en cryo-elektronenmicroscopie hebben het aantal en de complexiteit van de structuren die wetenschappers kunnen visualiseren snel vergroot.
Wat zijn Cryo-EM en Cryo-ET?
Cryo-elektronenmicroscopie of cryo-EM, gebruikt een camera om te detecteren hoe een elektronenstraal wordt afgebogen terwijl de elektronen door een monster gaan om structuren op moleculair niveau te visualiseren. Monsters worden snel ingevroren om ze te beschermen tegen stralingsschade. Gedetailleerde modellen van de structuur van belang worden gemaakt door meerdere afbeeldingen van individuele moleculen te nemen en deze te middelen tot een 3D-structuur.
Cryo-ET deelt vergelijkbare componenten met cryo-EM, maar gebruikt verschillende methoden. Omdat de meeste cellen te dik zijn om duidelijk in beeld te worden gebracht, wordt een interessegebied in een cel eerst uitgedund met behulp van een ionenbundel. Het monster wordt vervolgens gekanteld om er meerdere foto's van te maken onder verschillende hoeken, analoog aan een CT-scan van een lichaamsdeel (hoewel in dit geval het beeldvormingssysteem zelf wordt gekanteld, in plaats van de patiënt). Deze afbeeldingen worden vervolgens door een computer gecombineerd om een 3D-afbeelding van een deel van de cel te produceren.
De resolutie van dit beeld is hoog genoeg om onderzoekers (of computerprogramma's) de individuele componenten van verschillende structuren in een cel te laten identificeren. Onderzoekers hebben deze aanpak bijvoorbeeld gebruikt om te laten zien hoe eiwitten zich verplaatsen en worden afgebroken in een algen cel.
Veel van de stappen die onderzoekers ooit handmatig moesten uitvoeren om de structuren van cellen te bepalen, worden geautomatiseerd, waardoor wetenschappers nieuwe structuren met veel hogere snelheden kunnen identificeren. Bijvoorbeeld door cryo-EM te combineren met kunstmatige intelligentieprogramma's zoals AlphaFold kan beeldinterpretatie vergemakkelijken door eiwitstructuren te voorspellen die nog niet zijn gekarakteriseerd.
Celstructuur en -functie begrijpen
Naarmate beeldvormingsmethoden en workflows verbeteren, zullen onderzoekers enkele belangrijke vragen in de celbiologie met verschillende strategieën kunnen aanpakken.
De eerste stap is om te beslissen welke cellen en welke regio's binnen die cellen moeten worden bestudeerd. Een andere visualisatietechniek genaamd gecorreleerd licht en elektronenmicroscopie, of CLEM, gebruikt fluorescerende tags om gebieden te lokaliseren waar interessante processen plaatsvinden in levende cellen.
Vergelijking van de genetisch verschil tussen cellen kan extra inzicht geven. Wetenschappers kunnen kijken naar cellen die bepaalde functies niet kunnen uitvoeren en zien hoe dit wordt weerspiegeld in hun structuur. Deze aanpak kan onderzoekers ook helpen om te bestuderen hoe cellen met elkaar omgaan.
Cryo-ET zal waarschijnlijk nog enige tijd een gespecialiseerd hulpmiddel blijven. Maar verdere technologische ontwikkelingen en toenemende toegankelijkheid zullen de wetenschappelijke gemeenschap in staat stellen het verband tussen cellulaire structuur en functie te onderzoeken op voorheen ontoegankelijke detailniveaus. Ik verwacht nieuwe theorieën te zien over hoe we cellen begrijpen, van ongeorganiseerde zakken moleculen naar ingewikkeld georganiseerde en dynamische systemen.
Dit artikel is opnieuw gepubliceerd vanaf The Conversation onder een Creative Commons-licentie. Lees de originele artikel.
Krediet van het beeld: Nanografieën, CC BY-SA
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- Platoblockchain. Web3 Metaverse Intelligentie. Kennis versterkt. Toegang hier.
- Bron: https://singularityhub.com/2023/01/09/visualizing-the-inside-of-cells-at-previously-impossible-resolutions-provides-vivid-insights-into-how-they-work/
- 2018
- 3d
- a
- in staat
- de toegankelijkheid
- activiteit
- Extra
- Het toestaan
- Hoewel
- en
- Nog een
- anticiperen
- nadering
- dit artikel
- kunstmatig
- kunstmatige intelligentie
- geautomatiseerde
- tassen
- gebaseerde
- Balk
- omdat
- wordt
- worden
- vaardigheden
- Begin
- wezen
- tussen
- biologie
- lichaam
- overbrugging
- Dit betekent dat we onszelf en onze geliefden praktisch vergiftigen.
- camera
- dragen
- geval
- Cellen
- Eeuw
- gekarakteriseerde
- Steden
- duidelijk
- COM
- gecombineerde
- combineren
- Volk
- gemeenschap
- complex
- ingewikkeldheid
- ingewikkeld
- componenten
- computer
- content
- Creatieve
- Credits
- decennium
- decennia
- Verdiepen
- detail
- gedetailleerd
- gegevens
- Bepalen
- Ontwikkeling
- ontwikkelingen
- DEED
- verschil
- anders
- Ziekte
- beneden
- dynamisch
- elk
- gemakkelijker
- beide
- elektronen
- ingebed
- maakt
- genoeg
- Geheel
- Milieu
- essentieel
- Zelfs
- voorbeeld
- vergemakkelijken
- veld-
- Voornaam*
- geschikt
- Voormalig
- oppompen van
- bevroren
- functie
- functies
- verder
- kloof
- Genetica
- Kopen Google Reviews
- Google Maps
- meer
- Gezondheid
- hulp
- Hoge
- hoger
- geschiedenis
- huizen
- Hoe
- How To
- Echter
- HTTPS
- identificeren
- beeld
- afbeeldingen
- Imaging
- onmogelijk
- verbeteren
- in
- ontoegankelijk
- Inclusief
- meer
- meer
- individueel
- inzicht
- inzichten
- Intelligentie
- interactie
- belang
- interessant
- interpretatie
- IT
- zelf
- sleutel
- blijven
- Groot
- grootste
- LEARN
- Niveau
- niveaus
- Vergunning
- Life
- licht
- Waarschijnlijk
- LINK
- leven
- Kijk
- ziet eruit als
- gemaakt
- Magnetisch veld
- maken
- handmatig
- Maps
- maskeren
- methoden
- Microscopie
- modellen
- moleculair
- meest
- beweging
- bewegend
- meervoudig
- Nabij
- netwerk
- New
- aantal
- aangeboden
- EEN
- lopend
- Georganiseerd
- Overige
- Zuurstof
- deel
- bijzonder
- verleden
- patiënt
- PHP
- Foto's
- plaats
- Plato
- Plato gegevensintelligentie
- PlatoData
- Spelen
- potentieel
- het voorspellen van
- die eerder
- processen
- produceren
- Programma's
- Voortgang
- beschermen
- Eiwit
- Eiwitten
- zorgen voor
- biedt
- Contact
- snel
- Lees
- weerspiegeld
- regio
- regio
- blijven
- onderzoekers
- Resolutie
- Revealed
- onthullende
- rollen
- aftasten
- Wetenschap
- wetenschappers
- te zien
- verscheidene
- Vorm
- Aandelen
- tonen
- gelijk
- single
- sommige
- bron
- gespecialiseerde
- snelheden
- Start
- Stap voor
- Stappen
- strategieën
- structuur
- bestudeerd
- Studie
- dergelijk
- steunen
- system
- Systems
- Nemen
- het nemen
- technieken
- technologisch
- De
- hun
- Door
- niet de tijd of
- naar
- samen
- ook
- tools
- tools
- vervoeren
- begrijpen
- begrip
- visualisatie
- Wat
- welke
- en
- WIE
- wil
- binnen
- getuige
- Mijn werk
- samenwerken
- werkte
- workflows
- werkzaam
- röntgenstraal
- You
- youtube
- zephyrnet