Stel je een leger van zelfvoortstuwende, met radio-isotopen bedekte deeltjes voor, 2500 tot 10,000 keer kleiner dan een stofje, dat, wanneer het in het lichaam wordt geïnjecteerd, op zoek gaat naar kankertumoren, zich eraan hecht en deze vernietigt. Klinkt als sciencefiction? Dit geldt niet voor muizen met blaaskanker.
Onderzoekers in Spanje melden dat nanodeeltjes die radioactief jodium bevatten en die zichzelf voortstuwen na reactie met ureum, het vermogen hebben om kankerachtige blaastumoren te onderscheiden van gezond weefsel. Deze “nanobots” dringen de extracellulaire matrix van de tumor binnen en hopen zich daarin op, waardoor de radionuclidentherapie haar precieze doel kan bereiken. Uit een onderzoek uitgevoerd bij de Instituut voor Bio-engineering van Catalonië (IBEC) in Barcelona hadden muizen die een enkele dosis van deze behandeling kregen een vermindering van 90% in de grootte van blaastumoren vergeleken met onbehandelde dieren.
Deze nieuwe aanpak kan op een dag een revolutie teweegbrengen in de behandeling van blaaskanker. Blaaskanker is de tiende meest voorkomende vorm van kanker ter wereld, met meer dan 600,000 nieuwe gevallen gediagnosticeerd in 2022 en meer dan 220,000 sterfgevallen wereldwijd, volgens het Global Cancer Observatory van de Wereldgezondheidsorganisatie.
Niet-spierinvasieve blaaskanker, die verantwoordelijk is voor 75% van de gevallen, wordt momenteel behandeld door tumorresectie gevolgd door intravesicale injectie van chemotherapie of immunotherapie in de blaas. De toediening van medicijnen is echter bijzonder lastig vanwege de lage permeabiliteit van het urotheel (het weefsel dat de binnenkant van de urinewegen bedekt), het vullen van de urine met inhoud en het daaropvolgende uitwassen van medicijnen. Het proces is ook ongemakkelijk voor patiënten, omdat ze hun lichaam met tussenpozen moeten draaien terwijl ze op hun buik liggen, zodat de medicijnen alle kanten van de blaaswand kunnen bereiken. Na de behandeling is er een risico van 30-70% op herhaling binnen vijf jaar.
Om de klinische resultaten te verbeteren, hoofdonderzoeker Samuel Sanchez en collega's streven ernaar innovatieve en effectievere behandelingen voor blaaskanker te ontwikkelen en daarbij het aantal recidieven te verminderen. Bovendien zou een therapie met een enkele dosis de behandelingskosten aanzienlijk verlagen, waarvoor momenteel tussen de zes en veertien ziekenhuisopnames nodig zijn.
Het team creëerde nanobots van mesoporeuze silica-nanodeeltjes met verschillende functionele componenten op hun oppervlak. Deze omvatten radio-isotopen voor PET-visualisatie of radionuclidentherapie, en het eiwit urease, dat reageert met ureum in de urine en de voortstuwing van de nanobot mogelijk maakt.
Schrijven in Natuur Nanotechnologierapporteerden de onderzoekers dat toen ze een druppel nanobots toevoegden aan een oplossing die 300 mM ureum bevatte, de nanobots een zwermbeweging vertoonden en actieve en krachtige fronten en driedimensionale wervels vormden. Zonder het ureum sedimenteerden de nanobots eenvoudigweg in de buurt van de toevoegingsplaats.
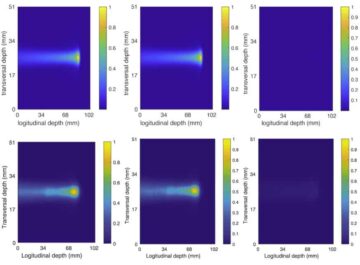
Om te onderzoeken of de nanobots een tumor kunnen bereiken in vivobeoordeelde het team hun gedrag bij tumordragende muizen. Positronemissietomografie (PET)-beelden lieten zien dat signalen van radioactief gemerkte nanobots zich op dezelfde locatie bevonden als de tumorpositie, zoals bepaald via MRI, waarbij de radioactiviteit voornamelijk op de doeltumorplaats werd waargenomen. Alleen muizen geïnjecteerd met nanobots plus ureum vertoonden een substantiële accumulatie in de tumormassa – nanobots afgeleverd in water, en controle-nanodeeltjes (zonder urease) afgeleverd in water of ureum vertoonden een minimale tumoropname.
De onderzoekers suggereren dat de mobiliteit van de nanobots hen helpt de tumormassa te penetreren. “Nanobots missen specifieke antilichamen om de tumor te herkennen, en tumorweefsel is doorgaans stijver dan gezond weefsel, maar dit is niet het geval bij blaastumoren”, legt co-eerste auteur uit Meritxell Serra Casablancas van IBEC. “We hebben waargenomen dat deze nanorobots de extracellulaire matrix van de tumor kunnen afbreken door de pH lokaal te verhogen via een zelfrijdende chemische reactie. Dit fenomeen bevorderde een grotere tumorpenetratie.” De onderzoekers denken dat de nanobots tegen het urotheel botsen alsof het een muur is, maar de tumor binnendringen die sponsachtiger is.
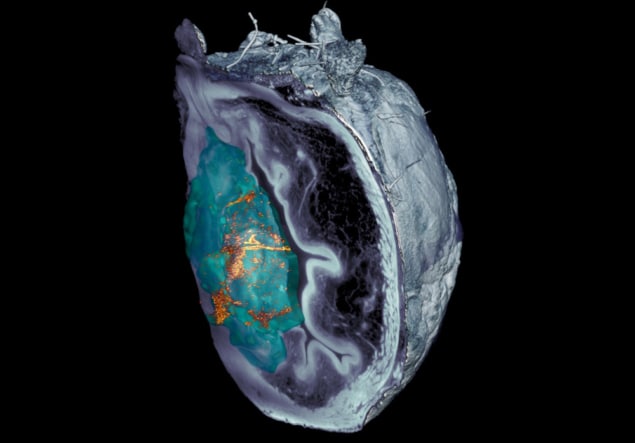
Het team merkt op dat het identificeren van de nanobots in microscopiebeelden van ontleed weefsel een uitdaging was. Nadat confocale optische microscopietechnieken faalden, ontdekten onderzoekers van IRB Barcelona ontwikkelde een op lichtplaten gebaseerd microscopiesysteem, gebaseerd op vlakke laserverlichting, dat in staat is de verschillende lagen van de blaas te scannen en een 3D-reconstructie van het hele orgaan te creëren.
“Het verstrooide elastische lichtmicroscopiesysteem dat we hebben ontwikkeld, heeft ons in staat gesteld het door de tumor zelf gereflecteerde licht te elimineren, waardoor we nanodeeltjes door het hele orgaan kunnen identificeren en lokaliseren zonder voorafgaande etikettering, met een ongekende resolutie”, zegt Julien Colombelli van IRB Barcelona.

Gemanipuleerde bacteriën trekken kankerdodende radio-isotopen aan in tumoren
Om het therapeutische effect van de techniek te evalueren, labelde het team nanobots met jodium-131 (131I, een radio-isotoop die gewoonlijk wordt gebruikt voor radionuclidentherapie), en diende deze toe aan de tumordragende muizen. Behandeling met verliesdosis 131I-nanobots in ureum stopten de tumorgroei, terwijl ze hoge doses gebruikten 131I-nanobots toegediend in ureum leidden tot een vermindering van het tumorvolume met bijna 90% vergeleken met niet-behandelde dieren.
Sánchez vertelt Natuurkunde wereld dat de volgende stappen van het team het inkapselen van kleine medicijnen zijn die momenteel bij chemotherapie worden gebruikt, en het blijven testen van de efficiëntie van nanobots als medicijndragers. Ze zijn uiteindelijk van plan de nanobots op te schalen en de regelgevingstrajecten te bestuderen om in de komende drie tot vier jaar richting de eerste klinische proeven te gaan, via de IBEC-spin-off. Nanobots-therapieën.
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- Bron: https://physicsworld.com/a/self-propelling-nanobots-shrink-bladder-tumours-in-mice-by-90/
- :is
- :niet
- $UP
- 000
- 10
- 135
- 14
- 2022
- 220
- 300
- 3d
- 600
- a
- vermogen
- Volgens
- accounts
- Accumuleren
- ophoping
- actieve
- toegevoegd
- toevoeging
- Daarnaast
- toegediend
- Na
- streven
- Alles
- Het toestaan
- ook
- an
- en
- dieren
- nadering
- ZIJN
- Leger
- gearresteerd
- AS
- geëvalueerd
- At
- hechten
- trekken
- auteur
- Bacterie
- Barcelona
- gebaseerde
- gedrag
- geloofd wie en wat je bent
- tussen
- lichamen
- lichaam
- Breken
- maar
- by
- CAN
- Kanker
- in staat
- carriers
- geval
- gevallen
- uitdagend
- chemisch
- Klinisch
- klinische proeven
- collega's
- in botsing komen
- COM
- Gemeen
- algemeen
- vergeleken
- componenten
- uitgevoerd
- content
- voortzetten
- onder controle te houden
- Kosten
- aangemaakt
- Wij creëren
- Op dit moment
- dag
- doden
- geleverd
- levering
- vastbesloten
- ontwikkelen
- ontwikkelde
- anders
- onderscheiden
- dosis
- beneden
- drug
- Drugs
- twee
- Stof
- effect
- effectief
- doeltreffendheid
- elimineren
- emissie
- in staat stellen
- ingeschakeld
- maakt
- waardoor
- Geheel
- EU
- schatten
- uiteindelijk
- onderzoeken
- tentoongesteld
- Verklaart
- Mislukt
- Fictie
- vulling
- Voornaam*
- vijf
- gevolgd
- volgend
- Voor
- vier
- oppompen van
- functioneel
- Globaal
- Wereldwijd
- meer
- HAD
- Hebben
- Gezondheid
- gezond
- helpt
- Echter
- HTTPS
- identificeren
- het identificeren van
- if
- afbeeldingen
- immunotherapie
- verbeteren
- in
- omvatten
- meer
- informatie
- innovatieve
- binnen
- voornemens zijn
- in
- kwestie
- IT
- HAAR
- zelf
- jpg
- etikettering
- Gebrek
- laser
- Legkippen
- LED
- licht
- als
- voering
- plaatselijk
- Laag
- Massa
- Matrix
- max-width
- Mei..
- Microscopie
- minimaal
- mobiliteit
- meer
- meest
- beweging
- beweging
- MRI
- NATUUR
- Nabij
- bijna
- Noodzaak
- New
- volgende
- nota
- roman
- observatorium
- of
- on
- EEN
- Slechts
- or
- resultaten
- over
- vooral
- paden
- patiënten
- doordringen
- een fenomeen
- Fysica
- Natuurkunde wereld
- Plato
- Plato gegevensintelligentie
- PlatoData
- plus
- positie
- nauwkeurig
- in de eerste plaats
- Principal
- Voorafgaand
- Voortbewegen
- voortstuwing
- Eiwit
- Tarieven
- bereiken
- reactie
- reageert
- ontvangende
- herken
- herhaling
- verminderen
- reductie
- weerspiegeld
- regelgevers
- verslag
- vereist
- onderzoekers
- Resolutie
- revolutioneren
- Risico
- zegt
- Scale
- het scannen
- verspreid
- Wetenschap
- Science Fiction
- Ontdek
- gezien
- vertoonde
- Sides
- signalen
- aanzienlijk
- eenvoudigweg
- single
- website
- ZES
- Maat
- Klein
- kleinere
- So
- oplossing
- geluiden
- Spanje
- specifiek
- Stappen
- Studie
- volgend
- wezenlijk
- stel
- system
- doelwit
- team
- technieken
- vertelt
- proef
- neem contact
- dat
- De
- de wereld
- hun
- Ze
- zich
- therapie
- Deze
- ze
- dit
- drie
- driedimensionaal
- Door
- overal
- thumbnail
- keer
- naar
- in de richting van
- behandeld
- behandeling
- behandelingen
- proeven
- waar
- BEURT
- typisch
- zonder precedent
- op
- opname
- us
- gebruikt
- divers
- via
- visualisatie
- volume
- Gevel
- was
- Water
- we
- waren
- wanneer
- of
- welke
- en
- Met
- binnen
- zonder
- wereld
- zou
- jaar
- zephyrnet