Termoradioterapi er en kreftbehandling der hypertermi – oppvarming av svulsten til over kroppstemperatur – brukes for å øke effekten av strålebehandling. Mengden av denne forbedringen er uttrykt som EQDRT, den ekvivalente stråledose som trengs for å oppnå samme terapeutiske effekt uten oppvarming.
Kliniske studier har vist at denne tilnærmingen kan forbedre behandlingsresultatene betydelig i flere tumortyper, uten å øke normal vevstoksisitet. Tidligere studier har også vist at både den oppnådde temperaturen og tidsintervallet mellom strålebehandling og hypertermi påvirker det kliniske resultatet.
For å forstå denne prosessen mer detaljert og bidra til å optimalisere behandlinger, har forskere ved Amsterdam UMC har brukt biologisk modellering for å undersøke effekten av maksimal temperatur og tidsintervall på EQDRT. Beskriver funnene deres i International Journal of Radiation Oncology Biology Physics, rapporterer de at både høye temperaturer og korte tidsintervaller er avgjørende for å maksimere terapeutisk forbedring.
Biologisk modell
For å utføre termoradioterapi bruker klinikere en radiofrekvens- eller mikrobølgeenhet for å påføre varme på svulsten en eller to ganger i uken, enten før eller etter en strålebehandlingsøkt. Tumortemperaturen holdes under 45°C for å forhindre oppvarming av normalt vev, men noen ganger kan det oppstå uønskede (og smertefulle) varme flekker, som begrenser det maksimale tolerable kraftnivået som kan brukes under en hypertermibehandling.
Første forfatter Petra Kok og kolleger utviklet programvare for å modellere de biologiske effektene av strålebehandling pluss hypertermi i form av ekvivalente dosefordelinger. Modellen, som står for DNA-reparasjonshemming ved hypertermi, så vel som direkte varmeindusert cytotoksisitet, muliggjør evaluering av kvaliteten på kombinerte behandlingsplaner ved bruk av standard dose-volum histogrammer.
For å få grunnleggende innsikt i virkningen av hypertermiparametere, beregnet teamet først forbedringen av en standard 23 × 2 Gy dosefordeling ved homogene temperaturer på mellom 37 og 43 °C, i tidsintervaller mellom 0 og 4 timer.
Modellen viste at EQDRT økt betydelig med både økende temperatur og synkende tidsintervall. For et tidsintervall på 1 time, for eksempel, spådde den en EQDRT økning på 2–15 Gy for temperaturer fra 39 til 43°C. Disse funnene understreker viktigheten av å oppnå den høyeste tolerable tumortemperaturen for å optimalisere det kliniske resultatet.
Påvirkningen av tidsintervallet var mest uttalt ved høyere temperaturer (over 41 °C). Ved en typisk hyperterm temperatur på 41.5°C, en EQDRT økning på ca. 10 Gy ble oppnådd med et 0 timers tidsintervall. Dette reduserte til rundt 4 Gy-forbedring med 4 timers intervall, noe som indikerer at når tidsintervallet øker, er det nødvendig med en høyere temperatur for å oppnå samme effekt.
Kliniske tilfeller
Deretter evaluerte forskerne realistiske behandlingsscenarier basert på inhomogene temperaturfordelinger og kliniske strålebehandlingsplaner. De beregnet EQDRT for 10 pasienter med lokalt avansert livmorhalskreft. Alle pasientene hadde mottatt 23 × 2 Gy volumetrisk-modulert lysbueterapi (VMAT), med hypertermi påført ukentlig under behandlingsforløpet.
Som sett med de ensartede temperaturene, EQDRT var størst for det minste tidsintervallet. Når hypertermi ble påført umiddelbart før eller etter strålebehandling (0 timers tidsintervall), gjennomsnittlig EQDRT til 95 % av volumet (D95 %) var 51.7 Gy – en gevinst på 6.3 Gy over stråling alene. Å øke tidsintervallet til 4 timer reduserte denne gevinsten til 2.2 Gy.
Modellen spådde at det meste av doseøkningen går tapt i løpet av den første timen. For klinisk bruk bør derfor tiden mellom strålebehandling og levering av hypertermi være så kort som mulig – ideelt for pasienter som får begge behandlingene på samme sykehus. Teamet bemerker at selv om rekkefølgen på de to behandlingene ikke er klinisk relevant, siden det tar tid å varme opp svulsten, kan bruk av hypertermi først muliggjøre betydelig kortere tidsintervaller, til og med nær 0 timer.
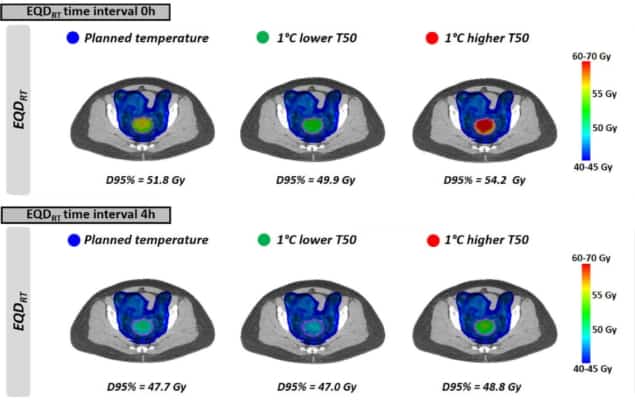
Til slutt modellerte forskerne virkningen av å oppnå litt lavere tumortemperaturer enn planlagt, på grunn av forekomsten av behandlingsbegrensende hot spots. Effekten på EQDRT var mest uttalt i et kort tidsintervall mellom strålebehandling og hypertermi. For en 1°C lavere temperatur og et tidsintervall på 0 timer, for eksempel, den gjennomsnittlige predikerte EQDRT(D95%) redusert med 1.8 Gy (fra 51.7 til 49.9 Gy); for et 4 timers intervall var nedgangen ca. 0.7 Gy.
Strålebehandling er mer effektiv ved oppvarmede svulster
I tilfeller hvor det ikke vises noen varme punkter, kan det være mulig å øke utgangseffekten og nå en høyere temperatur enn planlagt. Nok en gang var fordelen ved å oppnå en høyere temperatur størst for kortere tidsintervaller, med den eksakte gevinsten avhengig av de faktiske temperaturene som nås.
«Biologisk modellering gir relevant innsikt i forholdet mellom behandlingsparametere og forventet EQDRT", konkluderer Kok og kollegene. "Både høye temperaturer og korte tidsintervaller er avgjørende for å maksimere EQDRT.